Выбор рабочих параметров получения пептидов яичного белка
Автор: Болхонов Б.А., Соколов Д.В., Жамсаранова С.Д., Лебедева С.Н., Цянь Чен
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Статья в выпуске: 4 (87), 2022 года.
Бесплатный доступ
Получение функциональных пищевых ингредиентов, в том числе гидролизатов белков, является одним из инновационных направлений в пищевой промышленности. Ферментативный гидролиз белков является широко используемым методом модификации их функционально-технологических свойств и биологической активности. Целью настоящего исследования явилось получение гидролизата яичного альбумина с высокой степенью гидролиза на основе математических методов планирования эксперимента. Осуществлен двухстадийный процесс ферментативной конверсии яичного альбумина. Проведена серия двухфакторных исследований в направлении максимального значения степени гидролиза, которое было получено экспериментальным путем. Изучены два показателя ферментативной модификации - время гидролиза и фермент-субстратное соотношение (ФСС). Результаты оптимизированы с использованием методологии поверхности отклика в профессиональной программе Mathcad 15. Получен гидролизат со степенью гидролиза 82,56. Определены оптимальные показатели данного процесса: сначала гидролиз пепсином продолжительностью 5 ч при ФСС 1:20, а затем - трипсином продолжительностью 3 ч при ФСС 1:19. Дальнейшие исследования будут направлены на изучение биологической активности и функционально-технологических свойств гидролизата, а также определение его остаточной антигенности. Этот показатель является наиболее важной характеристикой гидролизатов белков для получения гипоаллергенных продуктов питания.
Яичный альбумин, пепсин, трипсин, гидролизат, степень гидролиза, факторные эксперименты, поверхность отклика
Короткий адрес: https://sciup.org/142236850
IDR: 142236850 | УДК: 664.38:57.014, | DOI: 10.53980/24131997_2022_4_15
Текст научной статьи Выбор рабочих параметров получения пептидов яичного белка
Разработка инновационных технологий, направленных на получение функциональных пищевых ингредиентов, в том числе гидролизатов белков, является одним из направлений модернизации пищевой промышленности.
Как известно, гидролизаты белков - это сложные смеси олигопептидов, пептидов и свободных аминокислот, образующиеся в результате реакции, происходящей с поглощением воды (реакции гидролиза). Гидролиз белков в настоящее время является широко используемым методом модификации их функциональных свойств: вязкости, растворимости, эмульгирования, пенообразования и др. [1]. Кроме того, гидролизаты обладают целым рядом преимуществ по сравнению с нерасщепленными белками: улучшение перевариваемости, быстрое усвоение организмом, доступность для питания людей с различными заболеваниями органов пищеварения, снижение антигенности, наличие биологически активных свойств (иммуномодулирующие, антиоксидантные, противовоспалительные, антигипертензивные, гиполипиде-мические и др.) [2].
В технологиях производства гидролизатов используются как химические (кислотный и щелочной), так и ферментативный методы (использование протеолитических ферментов и микробная ферментация). Ферментативный гидролиз по сравнению с химическим протекает в более «мягких» условиях (температура, кислотность, продолжительность), не вызывающих разрушения и трансформации аминокислот. Аминокислотный состав ферментативного гидролизата идентичен таковому исходного белка [1, 3].
Для производства гидролизатов используют самые разнообразные виды белкового сырья животного и растительного происхождения (казеин, сывороточные белки, яичный белок, белки мяса и субпродуктов; белки сои, риса, нута и других бобовых и зерновых культур; белковые отходы различных производств) [4, 5].
Свойства ферментолизатов зависят от их аминокислотного состава, определяемого условиями протеолиза и, в первую очередь, выбором фермента. Используется целый ряд коммерческих ферментов животного, микробного (бактериального, грибкового) и растительного происхождения (ферменты животного происхождения: пепсин, трипсин, панкреатин, а-хи-мотрипсин; протеолитические микробные ферменты: алкалаза, нейтраза, флаворзим, прото-субтилин, растительные ферменты: папаин, бромелайн и др.) либо отдельно, либо в виде композиций [6, 7].
Для обеспечения необходимых свойств гидролизатов необходимо контролировать количественные и качественные характеристики глубины гидролиза: содержание аминного азота, степень гидролиза, профиль молекулярно-массового распределения. Гидролизаты для специализированных пищевых продуктов (лечебного и профилактического питания) должны иметь высокую степень расщепления белка, так называемые «глубокие гидролизаты» [7].
Среди источников пищи яйцо сельскохозяйственной птицы является популярным и ценным продуктом. Белки куриного яйца обладают высокой биологической ценностью и представлены альбумином (75 %) и глобулином (2 %). Кроме того, в яичном белке содержатся овотрансферрин, лизоцим, авидин и белки, вызывающие аллергию, - овомукоид и овомуцин [8]. Аллергенность яичных белков можно снизить с помощью ферментативного гидролиза.
Ферментолизаты яичного белка перспективны для использования в составе пищевых продуктов как массового спроса, так и специализированных – для профилактики алиментарно-зависимых заболеваний [9]. Протеолиз яичного белка приводит к образованию биологически активных пептидов, проявляющих полифункциональные свойства [10, 11].
Таким образом, разработка технологий ферментативной модификации различных видов пищевого белкового сырья, в том числе и яичного белка, является актуальной задачей.
В предыдущей работе С.Д. Жамсаранова и др. (2021) получили ферментативный гидролизат из соевого белка со степенью гидролиза 82 - 83 % и выявили антиоксидантные свойства полученных пептидов [12].
Цель данной работы - получение гидролизата яичного альбумина с высокой степенью гидролиза на основе математических методов планирования эксперимента.
Материалы и методы исследования
В качестве объекта исследования для получения пептидов был использован яичный альбумин (Франция). Для протеолитического воздействия на белок использовали ферменты пепсин (РФ), трипсин (Чехия).
Для получения гидролизата был использован двухстадийный процесс. Гидролиз яичного альбумина пепсином проводили в 0,1М HCl (рН = 1,6). При проведении 2-й стадии гидролиза (гидролиз трипсином) изменяли рН реакционной смеси до 7,8 добавлением 10 % NaOH.
Протеолитическую активность ферментов определяли по ГОСТ 34430-2018.
Содержание общего азота определяли с реактивом Несслера по ОФС.1.7.2.0027.15, содержание аминного азота в негидролизованном сырье и полученных гидролизатах определяли методом формольного титрования (метод Серенса) по ОФС.1.2.3.0022.15.
Степень гидролиза (СГ) белка рассчитывали по формуле (1):
СГ = ^AA-NAAo} х 100%, (1) kNOA-NAAo/ , v v где NОА – содержание общего азота, %; NААо – содержание азота в негидролизованном сырье, %; NАА - содержание аминного азота в гидролизате после гидролиза в течение некоторого периода, %.
Оптимизацию параметров ферментативного гидролиза проводили с использованием программы Mathcad 15. Для нахождения максимального значения функции отклика и соответствующих ему значений факторов проводилась стандартная процедура нахождения максимума функции двух переменных в ограниченной области определения. Для получения значения функции желательности по значениям функции отклика использовали формулу Харрингтона [13].
Обработку экспериментальных данных проводили с использованием расчета средних значений (M), стандартной ошибки среднего (m) и параметрического критерия оценки (t-критерия Стьюдента). Результаты считали достоверными при достижении уровня значимости различий ( р ≤0,05).
Результаты исследования и их обсуждение
Для ферментативной конверсии яичного альбумина были выбраны ферменты пепсин и трипсин. Они доступны на российском рынке, относительно недорогие. Кроме того, применение этих протеаз моделирует естественный процесс гидролиза белка в организме.
Для проведения гидролиза яичного альбумина необходимо было оценить протеолитическую активность используемых ферментных препаратов. Полученные данные по ферментативной активности приведены в таблице 1.
Таблица 1
Протеолитическая активность пепсина и трипсина ( M±m )
|
Фермент |
Пепсин |
Трипсин |
|
Протеолитическая активность, ед/г |
198,3±13,5 |
1 150±79,8 |
После оценки протеолитической активности ферментных препаратов необходимо было подобрать условия ферментативного гидролиза для яичного альбумина. В качестве критерия эффективности процесса гидролиза использовали степень гидролиза белка, которую оценивали по динамике накопления аминного азота. Гидролиз пепсином проводили в оптимальных для данного фермента условиях: pH 1,6; t= t=39 ° C, но с разным фермент-субстратным соотношением (1:30, 1:20 и 1:10). Гидролиз трипсином также проводили в оптимальных для него условиях: pH=7,8; t=39 ° C; с разным фермент-субстратным соотношением (1:30, 1:20 и 1:10). Продолжительность гидролиза пепсином и трипсином составила 1 - 5 ч.
Полученные результаты по степени гидролиза яичного альбумина используемыми ферментами представлены соответственно в таблицах 2 и 3.
Таблица 2
Динамика степени гидролиза яичного альбумина пепсином ( M±m )
|
Вариант |
Степень гидролиза, % |
||
|
Продолжительность гидролиза, ч |
|||
|
1 |
3 |
5 |
|
|
1 вариант (1:30) |
39,31±0,53 |
49,12±0,24 |
61,4±0,45 |
|
2 вариант (1:20) |
30,7±0,28*1, 3 |
61,4±0,6*1, 3 |
70,4±0,21*1 |
|
3 вариант (1:10) |
40,51±0,31*1, 2 |
51,26±0,47*1, 2 |
69,6±0,81*1 |
Примечание. *1, 2, 3 – достоверно значимые отличия относительно 1, 2 или 3 варианта (р≤0,05).
Из данных, представленных в таблице 2, следует, что во всех вариантах гидролиза яичного альбумина пепсином наблюдалось достоверное увеличение его степени; наибольшая эффективность отмечена для второго варианта через 5 ч гидролиза (соотношение ФСС 1:20).
Таблица 3
Динамика степени гидролиза яичного альбумина трипсином (M±m)
|
Вариант |
Степень гидролиза, % |
||
|
Продолжительность гидролиза, ч |
|||
|
1 |
3 |
5 |
|
|
1 вариант (1:30) |
15,98±0,43 |
37,29±0,67 |
42,61±0,78 |
|
2 вариант (1:20) |
26,25±0,55*1, 3 |
31,1±0,43*1, 3 |
47,9±0,49*1 |
|
3 вариант (1:10) |
10,65±0,31*1, 2 |
37,5±0,41*1, 2 |
46,2±0,58*1 |
Примечание. *1, 2, 3 – достоверно значимые отличия относительно 1, 2 или 3 варианта (р≤0,05).
Из данных, представленных в таблице 3, следует, что во всех вариантах гидролиза трипсином яичного альбумина также наблюдалось увеличение его степени и наибольшая эффективность отмечена для второго варианта через 5 ч гидролиза (соотношение ФСС 1:20).
Для увеличения степени гидролиза и разработки двухстадийного процесса было проведено последовательное внесение выбранных ферментных препаратов: сначала вносили пепсин, затем трипсин при разных фермент-субстратных соотношениях (1:30, 1:20, 1:10). Вариант одновременного внесения ферментов не рассматривался, поскольку условия их действия (значения рН) разные. При двухстадийном процессе гидролиз проводили пепсином в течение 5 ч при ФСС 1:20 (табл. 2, 2 вариант), затем – трипсином в течение 3 ч. Полученные данные двухстадийного процесса представлены в таблице 4.
Таблица 4
Динамика степени гидролиза яичного альбумина при двухстадийном процессе (M±m)
|
Вариант |
Степень гидролиза, % |
||
|
Продолжительность гидролиза трипсином, ч |
|||
|
1 |
2 |
3 |
|
|
1 вариант (1:30) |
67,29±0,76 |
76,75±0,59 |
79,17±0,74 |
|
2 вариант (1:20) |
73,11±0,91*1, 3 |
80,85±0,67*3 |
82,56±0,66*3 |
|
3 вариант (1:10) |
64,56±0,64*1, 2 |
73,68±0,64*2 |
77,31±0,35*2 |
Примечание. *1, 2, 3 – достоверно значимые отличия относительно 1, 2 или 3 варианта (р≤0,05).
Из данных, представленных в таблице 4, следует, что применение двухстадийного процесса гидролиза способствовало увеличению его степени до максимального значения (82,56 %) во втором варианте, когда было использовано последовательное внесение пепсина (ФСС 1:20) в течение 5 ч, а затем трипсина (ФСС 1:20) в течение 3 ч.
На основании полученных данных для оптимизации ферментативного гидролиза яичного альбумина применяли факторные эксперименты с использованием математических методов.
Основными параметрами для оптимизаций служили:
-
• время гидролиза;
-
• фермент-субстратное соотношение (ФСС).
А. Результаты двухфакторного эксперимента
На базе запланированных уровней (табл. 5, 6) была составлена матрица двухфакторного эксперимента, по которой было проведено 9 опытов. При составлении структуры матрицы принималось, что при проведении всех экспериментов каждый уровень любого фактора встречается один раз с каждым уровнем всех остальных факторов.
Таблица 5
Уровни изучаемых факторов
|
Фактор |
Уровень |
||
|
1 |
2 |
3 |
|
|
Х1, продолжительность, ч |
1 |
3 |
5 |
|
Х2, фермент-субстратное соотношение |
1:10 |
1:20 |
1:30 |
Таблица 6
Уровни изучаемых факторов при двухстадийном гидролизе:
сначала пепсином 5 ч (при ФСС 1:20) и затем трипсином 3 ч
|
Фактор |
Уровень |
||
|
1 |
2 |
3 |
|
|
Х1, продолжительность гидролиза трипсином, ч |
1 |
2 |
3 |
|
Х2, фермент-субстратное соотношение |
1:10 |
1:20 |
1:30 |
Б. Результаты регрессионного анализа функции отклика
Для получения функции отклика была проведена множественная нелинейная регрессия с помощью полинома второго порядка в программе Statistica 10 и получены уравнения 2 - 4.
Функция отклика, характеризующая степень гидролиза пепсином:
Y(x1,x2) = 0,259x!2 - 331,167x2 + 5,317хг + 685,713x2 - 350,96.(2)
Функция отклика, характеризующая степень гидролиза трипсином:
Y(x1,x2) = 0,355xT2 - 301,457x22 + 4,122xT + 671,575x2 - 389,572.(3)
Функция отклика, характеризующая степень гидролиза пепсином и трипсином:
Y(x1,x2) = -2,468xT2 - 713,1x22 + 34,541xT + 1011,57x2 - 987,56.(4)
-
Оценка качества уравнений регрессии представлена в таблице 7.
Таблица 7
Оценка качества уровней регрессии
|
Показатели качества уравнения регрессии |
Показатели для гидролиза пепсином |
Показатели для гидролиза трипсином |
Показатели для двухстадийного гидролиза |
|
Индекс множественной корреляции |
R = 0,981 |
R = 0,973 |
R = 0,9922 |
|
Коэффициент детерминации |
R2= 0,986 |
R2= 0,944 |
R2= 0,985 |
|
Критерий Фишера |
F = 37,72, p < 0,002 |
F = 31,56, p < 0,002 |
F = 63,46, p < 0,001 |
Из приведенных в таблице 7 показателей следует, что полученные уравнения регрессии характеризуются высокой точностью и статистически надежны.
-
В. Результаты решения экстремальной задачи
Для нахождения максимального значения функции отклика и соответствующих ему значений факторов проводилась стандартная процедура нахождения максимума функции двух переменных в ограниченной области определения. При решении экстремальной задачи получено следующее решение (табл. 8).
Таблица 8
Результаты решения экстремальных задач
|
Фермент |
Значение факторов в точке максимума |
Значение функции отклика в точке максимума |
|
Пепсин |
Х 1 =7 ч, Х2=1:22 |
Y=77,631% |
|
Трипсин |
Х 1 =7 ч, Х2=1:30 |
Y=79,92% |
|
Пепсин (5 ч, ФСС 1:20) + трипсин |
Х 1 =3 ч, Х2=1:19 |
Y=88,275% |
Влияние технологических параметров на степень гидролиза яичного альбумина ферментными препаратами можно оценить контурами «желательности» в зависимости от значений этих факторов. Наиболее известной и используемой является функция желательности Харрингтона, применяемая в задачах оценки и оптимизации исследователями в разных сферах: экономике, технике и технологии, медицине, управлении, экологии и др. [13]. Числовые интервалы шкалы Харрингтона представлены в таблице 9.
Таблица 9
Числовые интервалы шкалы Харрингтона
|
Лингвистическая оценка |
Интервалы значений функции желательности |
Уровень |
|
Очень хорошо |
1,00 – 0,80 |
Допустимый и превосходный уровень |
|
Хорошо |
0,80 – 0,63 |
Допустимый и хороший уровень |
|
Удовлетворительно |
0,63 - 0,37 |
Допустимый и достаточный уровень |
|
Плохо |
0,37 – 0,20 |
Недопустимые уровни |
|
Очень плохо |
0,20 – 0,00 |
Как следует из данных таблицы 9, значение функции желательности, равное 0,37, используется в качестве границы допустимых значений. Полученные контуры «желательности» процессов гидролиза яичного альбумина: пепсином, трипсином и двухстадийного процесса в зависимости от продолжительности и фермент-субстратного соотношения представлены на рисунках 1–3. В нашем случае, чем больше значение функции желательности, тем выше степень гидролиза. При этом интервал значений функции желательности, равный 0,63 - 0,37, считается допустимым и достаточным уровнем [13].
Таким образом, в ходе экспериментальной обработки данных были выявлены факторы, способствующие интенсификации ферментативной конверсии яичного альбумина, и оптимальные параметры процесса. Для гидролиза пепсином продолжительность составила 7 ч, фермент-субстратное соотношение – 1:22. Для гидролиза трипсином продолжительность составила 7 ч, фермент-субстратное соотношение – 1:30.
Для двухстадийного гидролиза - сначала гидролиз пепсином в течение 5 ч при соотношении фермент-субстрат 1:20, затем трипсином продолжительностью 3 ч при фермент-суб-стратном соотношении – 1:19.
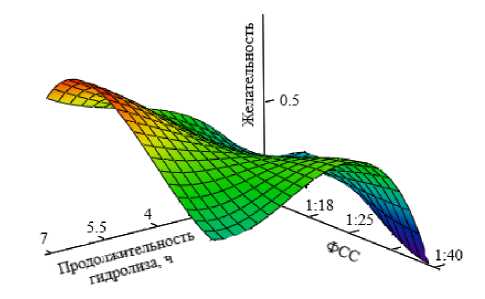
Рисунок 2 – Контур желательности степени гидролиза яичного альбумина трипсином в зависимости от продолжительности процесса и фермент-субстратного соотношения (ФСС)
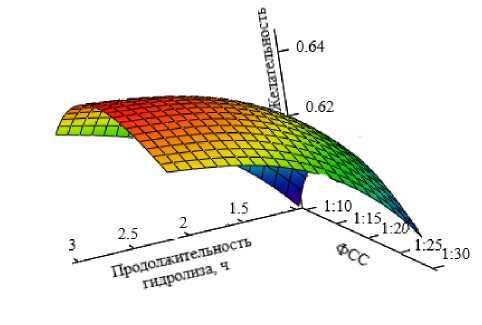
Рисунок 3 – Контур желательности степени двухстадийного гидролиза яичного альбумина сначала пепсином, затем трипсином в зависимости от продолжительности процесса и фермент-субстратного соотношения (ФСС)
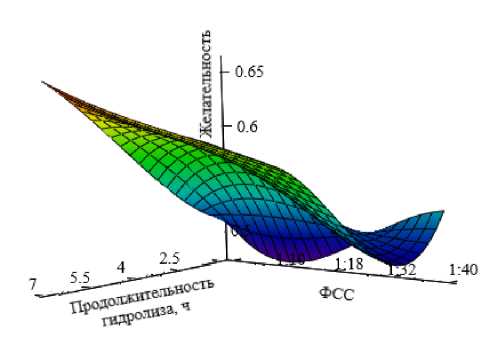
Рисунок 1 – Контур желательности степени гидролиза яичного альбумина пепсином в зависимости от продолжительности процесса и фермент-субстратного соотношения (ФСС)
Заключение
Таким образом, путем двухстадийного процесса ферментативной конверсии яичного альбумина получен гидролизат с высокой степенью гидролиза (82,56 %). Использование математических методов планирования эксперимента позволило определить оптимальные показатели данного процесса: сначала гидролиз пепсином продолжительностью 5 ч при ФСС 1:20, а затем – трипсином продолжительностью 3 ч при ФСС 1:19.
Дальнейшие исследования будут направлены на изучение биологической активности и функционально-технологических свойств полученного гидролизата, а также определение его остаточной антигенности. Этот показатель является наиболее важной характеристикой гидролизатов белков для получения гипоаллергенных продуктов питания.
Работа выполнена при поддержке грантов «Молодые ученые ВСГУТУ - 2022».


