Высокочувствительные и высокоспецифичные гены-маркеры мышечно- неинвазивного рака мочевого пузыря: KI67, CCNB1, MYBL2, TPA, BIRC5
Автор: Павлов А.Ю., Дзидзария А.Г., Боженко В.К., Гафанов Р.А., Халиль И.И., Солодкий В.А.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Урология
Статья в выпуске: 3 т.22, 2022 года.
Бесплатный доступ
Стратификация пациентов с мышечно-неинвазивным раком мочевого пузыря (МНИРМП) по группам риска является достаточно сложной задачей. Острым и не решенным вопросом на сегодняшний день является поиск специфичных и высокочувствительных генов-маркеров МНИРПМ для последующей оценки уровней их экспрессии и корреляцией с клиническим ответом, прогрессией и рецидивом заболевания на фоне лечения в различных клинических группах с применением существующих методик. Имеющиеся на текущий момент номограммы EORTC не учитывают молекулярно-генетический профиль МНИРМП и обладают недостаточной клинической ценностью. В данной работе было показано, что чувствительность и специфичность тестов, оценивающих экспрессию генов Ki67, CCNB1, MYBL2, TPA, BIRC5 у больных с МНИРМП составляет выше 75%, что позволяет считать их обладающими приемлемыми качествами для применения в медицинских исследованиях.
Прогностический, биомаркер, мышечно-неинвазивный рак мочевого пузыря, рак мочевого пузыря, молекулярные подтипы, ki-67, ccnb1, mybl2, tpa, birc5
Короткий адрес: https://sciup.org/149142248
IDR: 149142248
Текст научной статьи Высокочувствительные и высокоспецифичные гены-маркеры мышечно- неинвазивного рака мочевого пузыря: KI67, CCNB1, MYBL2, TPA, BIRC5
На момент постановки диагноза примерно 75% уротелиальных новообразований мочевого пузыря являются немышечноинвазивными [1]. Однако мышечно– неинвазивный рак мочевого пузыря (МНИРМП) является неоднородным заболеванием [2].
На протяжении многих лет предпринимались многочисленные попытки предсказать, какие опухоли будут рецидивировать и какие будут прогрессировать [3-5]. Чтобы облегчить прогнозирование риска для оптимизации лечения, такие характеристики как размер и количество опухолей, степень, стадия, предшествующие рецидивы и карцинома in situ (CIS) были включены в модели прогнозирования с системами подсчета очков, такие как системы Европейской организации по исследованию и лечению рака (EORTC) [2] и Испанского урологического клуба онкологического лечения (CUETO) [6]. Тем не менее, соответствие между предсказанными и наблюдаемыми результатами являются посредственными (0,64– 0,66 для рецидива и 0,7–0,75 для прогрессии) [2, 6]. Кроме того, они обеспечивают низкую положительную прогностическую ценность (21%-24%) для пациентов с высоким риском и, как правило, переоценивают риск прогрессирования [7]. Это говорит о том, что полагаться исключительно на клинические переменные недостаточно для стратификации риска у пациентов с МНИРМП [8].
Появление в настоящее время многочисленных работ по профилированию транскриптома оказало большое влияние на частоту обнаружения новых молекулярных маркеров или сигнатур экспрессии генов для классификации и прогнозирования исхода заболевания при различных видах рака, включая рак мочевого пузыря [9, 10]. Тем не менее было показано, что биомаркеры, которые, как было доказано, хорошо работают для прогнозирования исходов после цистэктомии, добавляют очень мало информации к прогностическим моделям немышечных инвазивных заболеваний, и необходимы дальнейшие исследования, включающие клинические данные совместно с анализом экспрессии генов, для повышения точности прогностических моделей в этой гетерогенной популяции [8]. Для решения поставленной задачи - поиска генов-маркеров МНИРМП с последующей клинической оценкой корреляции экспрессии и вариантов клинического течения в ФГБУ РНЦРР на базе отделения онкоурологии осуществлялся сбор клинического материала и последующий анализ в патологоанатомическом отделении и в научноисследовательском отделе молекулярной биологии и экспериментальной терапии опухолей ФГБУ РНЦРР.
Материалы и методы исследования
В исследование были включены три группы пациентов. Первую группу (исследовательскую) составили 83 первичных пациента с диагнозом МНИРМП. Этим пациентам была выполнена цистоскопия с фотодинамической диагностикой и удалением первичной опухоли мочевого пузыря с одномоментной биопсией образования и морфологически неизмененной стенки. Во вторую группу были включены пациенты ( n =81), прошедшие специализированное противоопухолевое лечение (ТУР+ХТ 6-8 введений) МНИРМП и находящиеся в стадии безрецидивного динамического наблюдения. Этим пациентам выполнялась биопсия мочевого пузыря. В третью группу (контрольная) было отобрано 70 пациентов без РМП в анамнезе, но с онкологией иной локализации в прошлом, мочекаменной болезнью или доброкачественной гиперплазией предстательной железы. Этим пациентам также выполнялась цистоскопия с биопсией при плановом обследовании.
В исследовании была изучена широкая панель генов: MGB1, CTSL2, BCL2, COX-2, IFG-2, CYP19A, TERT, HER2, PTEN, MMP9, GSTM1, GNLY, P14ARF ( P19ARF), IGF1, PGR, GREM1, MMP2, PAPPA, MMP7, IL2, BAX, VEGFA165, TLR2, P16INK4A, SCUBE2, MMP8,
IL2Ra, IL6, IL12a, IL7, IL15, STK15, MYBL2, VEGFA121, IL8, IL1b, IL10, TPA, IFNγ, CD45, TNF-α, C-MYC, BIRC5, CCND1, NDRG1, CD68, Ki67, CD56, TGFb, CD69, VEGFA189, TLR4, HLA-G1, TLR-7, HLA-G5, GATA2, Il-28a, LGALS1, Il-29, LIF, LIFR, CCNB1, ESR1, GRB7, MMP11 .
В последующем оценивалась и сравнивалась безрецидивная выживаемость в 1 -ой и 2ой группах. Всем пациентам в обеих группах была выполнено комбинированное лечение в объеме ТУР + внутрипузырная химиотерапия препаратом Митомицин-С (6-8 введений) с последующими регулярными цистоскопиями.
Экспрессия мРНК измерялась с помощью панелей ООО «ДНК Технология» Россия. Нормализация была выполнена с использованием 3-х генов контроля, а именно, генов «домашнего хозяйства» (housekeeping genes): B2M , GUSB и HPRT1.
Результаты исследованияХарактеристика пациентов
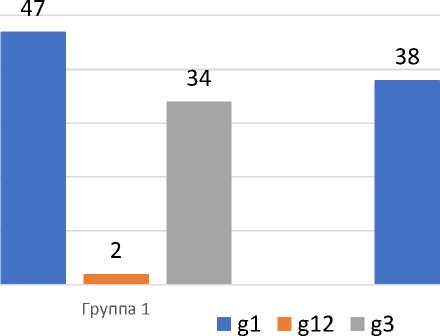
Средний возраст в нашем исследовании составил 66,3 года в первой группе, 60,8 лет во второй и 58,4 в третьей группах. Большая часть больных была старше 44 лет, а медиана составила 62 года. Группы пациентов были изучены в зависимости от морфологической характеристики опухоли, различий в 1 и 2 группах выявлено не было (р >0,05) (Рис. 1).

Группа 2
10 0
Рис. 1. Распределение пациентов, вошедших в исследование, в зависимости от степени дифференцировки опухоли (g - grade).
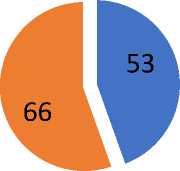
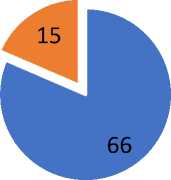
При изучении факта наличия гематурии была выявлено увеличение уровня гематурий в группе 2. Наличие гематурии наблюдалось у 53 пациентов в первой группе (63,9%) и у 66 во второй группе (81,5%) (Рис. 2).
группа 1
группа 2
есть
есть
Рис. 2. Макрогематурия в группах пациентов, вошедших в исследование.
Мы также изучили распределение наиболее известных факторов риска развития канцерогенеза, таких как ожирение и курение табака (Рис. 3). Во всех группах прослеживается тенденция к наличию лишнего веса (2/3 пациентов).
индексы массы тела
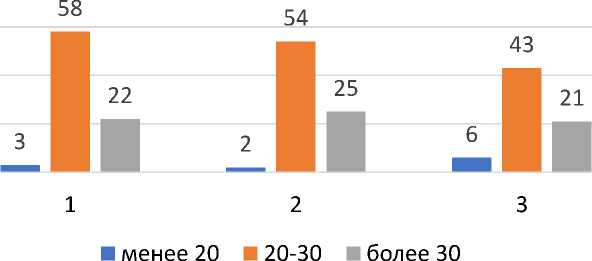
Рис. 3. Распределение показателя индекса массы тела в исследуемых группах.
В нашем исследовании использовались классические общепринятые факторы прогноза, основанные на клинико-морфологических параметрах опухолевых очагов (Рис. 4, 5).
Число очагов
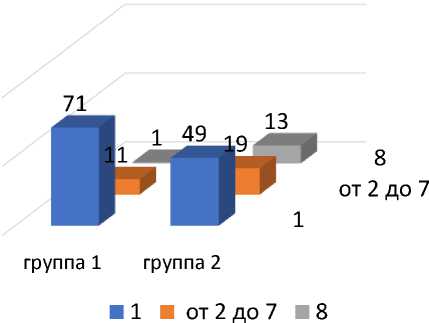
Рис. 4. Распределение пациентов по числу очагов в группах сравнения.
Размер очагов
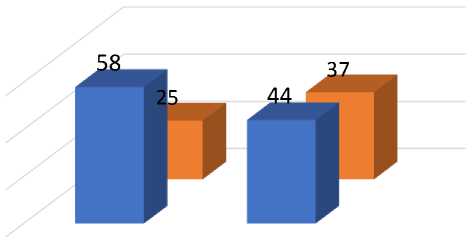
группа 1
группа 2
менее 3 см более и равно 3 см
Рис. 5. Распределение пациентов по размеру очагов в группах сравнения.
В 1-ой группе определялось больше больных с единичным очагом: 85,5% в первой по сравнению с 60,5% во второй группах, соответственно (р <0,05). Имелась тенденция к большему количеству пациентов с размером первичной опухоли менее 3 см: 69,9% в первой и 54,4% во второй группах, однако различия недостоверны (р >0,05).
Генетические исследования
Распределение генов на три клинические группы было выполнено с учетом чувствительности (экспрессия подтверждает наличие рака) и специфичности (отсутствие рака при низкой экспрессии: (А) высокочувствительные и высокоспецифичные гены (75%+);
(В) гены с умеренной чувствительностью и специфичностью (от 50% до 75%); (С) гены не имеющие клинического значения
В группу А вошли: маркеры пролиферации Ki67, CCNB1, MYBL2, TPA и маркер ингибитора апоптоза - BIRC5 . Наилучшее соотношение чувствительности и специфичности, разделяющее группы контроля от группы больных с МНИРМП, было получено для генов со следующими пороговыми значениями: Ki-67 - 30; CCNB1 - 83; MYBL2 - 60; BIRC5 - 16; ТРА -300 (примеры представлены в Табл. 1-4).
Таблица 1. Данные чувствительности и специфичности показателя Ki-67
|
Группы |
Ki-67 |
Всего |
|
|
<30 |
>30 |
||
|
1 |
14 (23,7%) * |
< 45 (76,3%)^ |
59 |
|
2 |
29 (78,4%) * |
8 (21,6%) |
37 |
|
3 |
С36 (75%) Q |
12 (25%) |
48 |
|
Всего |
79 |
65 |
144 |
* р <0,0001
Таблица 2. Данные чувствительности и специфичности показателя MYBL2
|
Группы |
MYBL2 |
Всего |
|
|
<60 |
>60 |
||
|
1 |
20 (24,1%) |
<6 3 (75,9% )*) |
83 |
|
2 |
61 (75,3%) * |
20 (24,7%) |
81 |
|
3 |
С58 (82,9% )*> |
12 (17,1%) |
70 |
|
Всего |
139 |
95 |
234 |
* р <0,0001
Таблица 3. Данные чувствительности и специфичности показателя ТРА
|
Группы |
ТРА |
Всего |
|
<300 |
>300 |
||
|
1 |
11 (19%) |
<2 7 47 (81%Д *> |
58 |
|
2 |
34 (82,9%)* |
7 (17,1%) |
41 |
|
3 |
< 33 (75%) *> |
11 (25%) |
44 |
|
Всего |
78 |
65 |
143 |
* р <0,0001
Таблица 4. Данные чувствительности и специфичности показателя BIRC5
|
Группы |
BIRC5 |
Всего |
|
|
<16 |
>16 |
||
|
1 |
20 (24,1%) |
<763(75Д%)^> |
83 |
|
2 |
61 (75%) |
20 (25%) |
81 |
|
3 |
«53 (75,7%)О |
17 (24,3%) |
70 |
|
Всего |
134 |
100 |
234 |
* р <0,0001
В группу В вошли: PGR, ESR1, BCL2, СD45, GRB7, IL-2, IL-12, Il-15, IL-7, p16INK4A, РАРРА, SCUBE2, TNF-α, VEGFA121, VEGFA165, VEGFA189, ММР2, ММР7, ММР11, CD68, CD69, CCND1, C-MYC, BAG1, IFNy, TLR2, TLR4, TLR7, CYP19A ( CYP19A1 ) , COX2 .
В группу С вошли: MGB1, CTSL2v, TERT, HER2, PTEN, GREM1, MMP8, IL2Ra, IL6, IL8, IL1b, IL10, NDRG1, CD56, TGFb, HLA-G1, HLA-G5, GATA2, Il-28a, LGALS1, Il-29, LIF, LIFR, STK15, BAX, MMP9, GSTM1, GNLY, P14ARF ( P19ARF), IGF1, IGF2.
Данные по уровням экспрессии м-РНК изученных генов представлены в таблице 5.
Таблица 5. Данные по уровням экспрессии м-РНК изученных генов
|
Лек |
.\4диан«вдортак |
F |
Cem с оезреу^дизчой еыэ№и£аелмх¥г.ью |
||||
|
2 |
3 |
Порог |
9 |
||||
|
MNGBL1 |
5^9 1 |
153 |
175 |
0,0006 |
0,02 |
нет |
>0,05 |
|
CTSL2 |
14.4 |
8.0 |
3.9 |
0.06 |
0.1 |
>15 |
0.34 |
|
BCL2 |
92.1 J |
304 |
304 |
0,0003 |
<0.0001 |
нет |
>0,05 |
|
с-мтс |
10.2 |
S.O |
5.1 |
sO.5 |
0.04 |
нет |
>0,05 |
|
BIRC5 |
105 t |
27,9 |
36.3 |
0,002 |
0.002 |
>60 |
0,04 |
|
CCND1 |
+5,9 |
23,3 |
34,9 |
0,0004 |
0,08 |
>95 |
0,1 теш |
|
XDRGI |
991 1 |
3214 |
3822 |
0.1 |
0.2 |
нет |
>0.05 |
|
CD68 |
6.5 |
6.7 |
".0 |
>0,05 |
>0,05 |
нет |
>0,05 |
|
Ki-67 порог 30 |
76.1 t |
10.6 |
14.7 |
<0.0001 |
<0.0001 |
>30 |
0.024 |
|
TERT |
16,0 |
17,1 |
12.1 |
0.5 |
>3.5 |
нет |
>0,05 |
|
HER2 |
16,8 |
12.5 |
16.6 |
0.2 |
>3.5 |
>20 |
0.09тенд |
|
PTES' |
1.7 |
4.3 |
4.5 |
0.3 |
0.4 |
нет |
>0.05 |
|
BAGJ |
7.6 |
S.O |
7,2 |
>0,05 |
>0,05 |
нет |
>0,05 |
|
PGR порог 270 |
56.3 1 |
655 |
530 |
<0.0001 |
<0.0001 |
нет |
>0,05 |
|
CCNB1 порог 205 |
172 t |
55,7 |
53.0 |
<0,0001 |
<0.0001 |
>205 |
0,045 |
|
ESRi |
"1.1 I |
416 |
332 |
<0,0001 |
<0,0001 |
нет |
0Д5 |
|
GRB7 |
4390 I |
1911 |
1722 |
0.0003 |
<0.0001 |
нет |
>0,05 |
|
MMP11 |
56,8 |
73^ |
0,1 |
||||
|
STKI5 |
83.0 |
0.09 |
>120 |
0.027 |
|||
|
MIBL2 порог 60 |
256 f |
1":5 |
25.6 |
<0,0001 |
<0.0001 |
>60 |
0,01 |
|
Р16ГЖ4А |
39.4 t |
24.3 |
25.1 |
<0.0001 |
0.0001 |
нет |
>0.05 |
|
SCGBE 2 |
33$ 1 |
533 |
1176 |
0.4 |
0,0036 |
нет |
>0,05 |
|
MMP9 |
907 j |
2358 |
1305 |
0,05 |
0,3 |
нет |
>0,05 |
|
GSTM1 |
5599 1 |
1SS1 |
3566 |
>3.5 |
>3.5 |
>5600 |
0.1 теш |
|
GMT |
280 J |
539 |
972 |
0,19 |
0,0036 |
нет |
>0,05 |
|
PK4RF |
65,6 |
71.0 |
62.9 |
>0,5 |
XX5 |
нет |
>0,05 |
|
IGF1 |
53,8 1 |
294 |
265 |
<0,0001 |
<0,0301 |
нет |
>0,05 |
|
COB |
$61 ] |
1176 |
1116 |
0.4 |
>3.5 |
нет |
>0,05 |
|
TGF2 |
47$ |
402 |
803 |
>3.5 |
0.3 |
нет |
>0,05 |
|
CIP19A |
$03 |
1912 |
1136 |
0,05 |
0.3 |
нет |
>0,05 |
|
GREM |
270 . . |
92$ |
955 |
0.008 |
0.3 |
нет |
>0,05 |
|
MMP2 |
163 |
270 |
431 |
0.2 |
0,03 |
нет |
>0,05 |
|
PAPPA |
235 |
1526 |
1117 |
<0.0001 |
0.0003 |
нет |
>0.05 |
|
MMP7 |
84,4 |
64,0 |
90,5 |
>0,05 |
>3.5 |
нет |
>0,05 |
|
Д2 |
50,2 . |
204 |
160 |
<0,0001 |
<0.0001 |
нет |
>0,05 |
|
MMPS |
+2.2 |
"3.5 |
115 |
0.5 |
0.2 |
нет |
>0.05 |
|
PHRa |
13$ |
247 |
239 |
0.3 |
>3.5 |
нет |
>0,05 |
|
Л6 |
24.3 1 |
452 |
89.6 |
0.0001 |
0.049 |
нет |
>0.05 |
|
Ш2а |
8.1 |
19,7 |
20.4 |
<0,0001 |
0,0005 |
нет |
>0,05 |
|
Л7 |
13:5 |
23.3 |
30,9 |
0,0004 |
<0,0301 |
нет |
>0,05 |
|
m5 |
15.5 |
2 ".5 |
28.3 |
0.0006 |
0.0003 |
нет |
>0,05 |
|
Л8 |
92$ ' |
431 |
344 |
0,07 |
0,002 |
нет |
>0,05 |
|
mo |
212 |
256 |
216 |
0.4 |
>3.5 |
нет |
>0,05 |
|
то |
59,7 |
108 |
72,3 |
0,1 |
>3.5 |
нет |
>0,05 |
|
ТРА порог 300 |
1177 ' |
142 |
114 |
<0.0001 |
<0.0001 |
>400 |
0.18 теш |
|
+1.2 |
114 |
181 |
<0,0001 |
<0.0301 |
<40 |
0,18 теш |
|
|
CD45 |
55.4 |
304 |
234 |
0,0002 |
<0.0301 |
нет |
>0,05 |
|
Г,Ей |
63.6 |
142 |
111 |
<0.0001 |
0.002 |
нет |
>0.05 |
|
CD56 |
326 |
3446 |
1526 |
<0.0301 |
0.001 |
нет |
>0,05 |
|
тать |
445 1 |
"50 |
763 |
0.0004 |
0.002 |
нет |
>0.05 |
|
CD69 |
55$ 1 |
989 |
1261 |
0,009 |
0,008 |
нет |
>0,05 |
|
IEGFA121 |
13,7 |
S.O |
7,5 |
0,0003 |
<0,0301 |
нет |
>0,05 |
|
ВАХ |
71,0 1 |
169 |
147 |
0.002 |
0.09 |
нет |
>0.05 |
|
FEGEAI65 |
20,0 |
12.1 |
11.3 |
0,004 |
0,001 |
нет |
>0,05 |
|
TLR2 |
61.8 |
0.08 |
0.02 |
||||
|
1EGFAJ89 |
92.1 | |
55,7 |
55.7 |
0.005 |
0.005 |
нет |
>0,05 |
|
TLR4 |
25.1 |
23.4 |
3S.1 |
>0.5 |
0,005 |
нет |
>0,05 |
|
HLA-GI |
69.6 1 |
402 |
"50 |
0.6 |
0,03 |
нет |
>0,05 |
|
TLR7 |
5C:2 1 |
73,5 |
90,5 |
0.1 |
0.002 |
нет |
>0,05 |
|
HLA-G5 |
175 1 |
137 |
461 |
0.4 |
0,005 |
нет |
>0,05 |
|
GATA3 |
9'2 f |
61.8 |
599 |
0,008 |
>4X5 |
нет |
>0,05 |
|
IL2S |
0 |
0 |
- |
- |
|||
|
LGALSI |
1097 |
204S |
2896 |
0.049 |
0,0001 |
- |
|
|
IL29 |
V |
V |
0 |
- |
- |
- |
|
|
ЕЕ |
0 |
2 |
0 |
||||
|
LIFR |
1305 1 |
4624 |
11585 |
0.013 |
<0,0001 |
нет |
>0,05 |
-L-7U
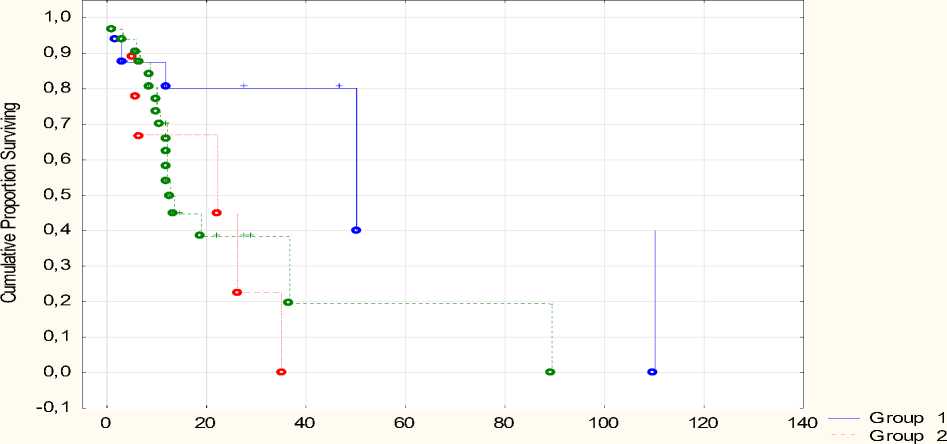
Данные по безрецидивной выживаемости (БРВ) в зависимости от уровней экспрессии генов-маркеров представлены в таблице 6 и на рисунке 6.
Таблица 6. Данные по безрецидивной выживаемости в разных группах экспрессии
|
Группы |
Период (годы) |
Безрецидивная выживаемость |
Медиана БРВ |
|
1 Все гены-маркеры имеют низкие уровни экспрессии |
1 |
82,2 ± 10,3% |
41,6 месяцев |
|
2 |
|||
|
3 |
|||
|
4 |
|||
|
5 |
40,1 ± 28,8% |
||
|
2 Все гены-маркеры имеют высокие уровни экспрессии |
1 |
55,2 ± 9,5% |
13 месяцев* |
|
2 |
39,1 ± 10,3% |
||
|
3 |
20,2 ± 14,5% |
||
|
3 Все сочетания генов-маркеров, не вошедших в группы А и В |
1 |
78,3 ± 12,3% |
22,9 месяцев |
|
2 |
46,1 ± 10,1% |
||
|
3 |
23,2 ± 14,7% |
* p <0,001 (группы 1 и 2)
Cumulative Proportion Surviving (Kaplan-Meier) Complete Censored
Time Group 3
Рис. 6. Данные по безрецидивной выживаемости при различных сочетаниях уровней экспрессии мРНК генов-маркеров.
Обсуждение
В нашем исследовании пять генов ( Ki67, CCNB1, MYBL2, TPA, BIRC5 ) оказались наиболее аккуратными предикторами для МНИРМП и четыре из них ( Ki67, CCNB1, MYBL2, BIRC5 ) коррелировали также с клиническим течением.
Ki67 (MKI67) кодирует ядерный белок, который связан с клеточной пролиферацией и может быть необходим для нее. Опухолевые клетки активно пролиферируют и экспрессируют К167 во всех фазах клеточного цикла, за исключением GO-периода. Пролиферативная активность определяет скорость роста опухоли, риск метастазирования и потенциальный ответ на терапию. Иммуногистохимическая оценка Ki67 в настоящее время включена в клиническую практику для нескольких типов рака из-за его надежной корреляции с пролиферативной активностью раковых клеток [11].
Нормальный клеточный цикл контролируется синхронизированной и последовательной регуляцией активности циклин-зависимых киназ. Циклины A, D и E опосредуют переход от G1 к S-стадии, в то время как циклины A и B обеспечивают переход от G2 к M-стадии. Циклин B1 (CCNB1) является важным компонентом пути клеточного цикла, и был идентифицирован как один из генов-хабов, оказывающих существенное влияние на развитие отдельных видов рака [12].
Ядерный белок, кодируемый геном MYBL2 , является членом семейства генов фактора транскрипции MYB, участвующим в прогрессировании клеточного цикла. Кодируемый белок фосфорилируется циклином А/циклин-зависимой киназой 2 в S-фазе клеточного цикла и обладает как активирующей, так и репрессорной активностью. Было показано, что MYBL2 был высоко экспрессирован и связан со стадией и степенью тяжести для большинства видов рака. Высокая экспрессия MYBL2 положительно коррелировала с плохим прогнозом для большинства онкологических больных. Белое MYBL2 может воздействовать на иммунное микроокружение опухоли, влияя на уровень иммунной инфильтрации и уровень экспрессии CD4+ Т-клеток, CD8+ Т-клеток, ассоциированных с раком фибробластов (CAFs) и клеток, ассоциированных с иммунными контрольными точками. MYBL2 может играть решающую роль при раке, регулируя сплайсосомы, репликацию ДНК и клеточный цикл [13].
BIRC5 кодирует белок сурвивин, также называемый бакуловирусным ингибитором апоптоза, содержащим повтор 5. BIRC5 является членом семейства генов ингибитора апоптоза, которые кодируют негативные регуляторные белки, предотвращающие апоптотическую гибель клеток. Экспрессия этих генов высока во время внутриутробного развития и в большинстве опухолей, но низка во взрослых тканях. Сурвивин в изобилии содержится в большинстве раковых клеток различных злокачественных новообразований, что делает его многообещающей мишенью для противораковых препаратов и потенциальным прогностическим инструментом [14].
TPA (PLAT) кодирует активатор плазминогена тканевого типа, секретируемую сериновую протеазу, которая превращает проэнзим плазминоген в плазмин, фибринолитический фермент, который частью системы активатора плазминогена (ПА). ПА система не только участвует в растворении сгустков, образованных фибринами, но и в других биологических процессах, таких как эмбриогенез, ангиогенез, миграция клеток, заживление ран, воспалительная реакция, а также апоптотическая гибель клеток. При раке система ПA играет важную роль в росте опухоли, ангиогенезе, инвазии опухолевых клеток, миграции и метастазировании [15].
Полученные наи результаты коррелируют с литературными данными и дополняют классификации, основанные на клинических и гистопатологических факторах риска; они могут помочь в стратификации пациентов с МНИРМП для оптимизации схем лечения и последующего наблюдения.
Выводы
Чувствительность и специфичность тестов, оценивающих экспрессию Ki67, CCNB1, MYBL2, TPA, BIRC5 составляет выше 75%, что позволяет считать их обладающими приемлемыми качествами для применения в медицинских исследованиях.
При анализе корреляции данных экспрессии мРНК генов Ki67, CCNB1, MYBL2, TPA, BIRC5 с БРВ пациентов с, для гена TPA корреляция с клиническим течением (прогрессия и рецидив) не выявлена.
Многофакторный анализ изучения взаимосвязи экспрессии мРНК генов-маркеров и клинико-морфологических параметров у пациентов с МНИРМП позволяет оценить клинические группы, в которых целесообразно выполнять молекулярно-генетический анализ.
Список литературы Высокочувствительные и высокоспецифичные гены-маркеры мышечно- неинвазивного рака мочевого пузыря: KI67, CCNB1, MYBL2, TPA, BIRC5
- Kirkali Z., Chan T., Manoharan M., et al. Bladder cancer: epidemiology, staging and grading, and diagnosis. Urology. 2005. V. 66. No. 6. Suppl. 1. P. 4-34. DOI: 10.1016/j.urology.2005.07.062.
- Sylvester R.J., van der Meijden A.P.M., Oosterlinck W., et al. Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials. Eur Urol. 2006. V. 49. No. 3. P. 466-477. DOI: 10.1016/j.eururo.2005.12.031.
- van den Bosch S., Alfred Witjes J. Long-term cancer-specific survival in patients with high-risk, non-muscle-invasive bladder cancer and tumour progression: a systematic review. Eur Urol. 2011. V. 60. No. 3. P. 493-500. DOI: 10.1016/j.eururo.2011.05.045.
- Babjuk M., Burger M., Zigeuner R., et al. EAU guidelines on nonmuscle-invasive urothelial carcinoma of the bladder: update 2013. Eur Urol. 2013. V. 64. No. 4. P. 639-653. DOI: 10.1016/j.eururo.2013.06.003.
- Martin-Doyle W., Leow J.J., Orsola A., et al. Improving selection criteria for early cystectomy in high-grade t1 bladder cancer: a metaanalysis of 15,215 patients. J Clin Oncol. 2015. V. 33. No. 6. P. 643-650. DOI: 10.1200/JC0.2014.57.6967.
- Fernandez-Gomez J., Madero R., Solsona E., et al. Predicting nonmuscle invasive bladder cancer recurrence and progression in patients treated with bacillus Calmette-Guerin: the CUETO scoring model. J Urol. 2009. V. 182. No. 5. P. 2195-2203. DOI: 10.1016/j.juro.2009.07.016.
- Xylinas E., Kent M., Kluth L., et al. Accuracy of the EORTC risk tables and of the CUETO scoring model to predict outcomes in non-muscleinvasive urothelial carcinoma of the bladder. Br J Cancer. 2013. V. 109. No. 6. P. 1460-1466. DOI: 10.1038/bjc.2013.372
- Passoni N., Gayed B., Kapur P., et al. Cell-cycle markers do not improve discrimination of EORTC and CUETO risk models in predicting recurrence and progression of non-muscle-invasive high-grade bladder cancer. Urol Oncol. 2016. V. 34. No. 11. P. 485.e7-485.e14. DOI: 10.1016/j.urolonc.2016.05.014.
- Dyrskjot L., Zieger K., Real F.X., et al. Gene expression signatures predict outcome in nonmuscle-invasive bladder carcinoma: a multicenter validation study. Clin Cancer Res. 2007. V. 13. No. 12. P. 3545-3551. DOI: 10.1158/1078-0432.CCR-06-2940.
- Dyrskj0t L., Reinert T., Algaba F., et al. Prognostic Impact of a 12-gene Progression Score in Non-muscle-invasive Bladder Cancer: A Prospective Multicentre Validation Study. Eur Urol. 2017. V. 72. No. 3. P. 461-469. DOI: 10.1016/j.eururo.2017.05.040.
- Miller I., Min M., Yang C., et al. Ki67 is a Graded Rather than a Binary Marker of Proliferation versus Quiescence. Cell Rep. 2018. V. 24. No. 5. P. 1105-1112.e5. DOI: 10.1016/j.celrep.2018.06.110.
- Li S., Liu N., Piao J., et al. CCNB1 Expedites the Progression of Cervical Squamous Cell Carcinoma via the Regulation by FOXM1. Onco Targets Ther. 2020. V. 13. P. 12383-12395. DOI: 10.2147/OTT.S279951.
- Chen X., Lu Y., Yu H., et al. Pan-cancer analysis indicates that MYBL2 is associated with the prognosis and immunotherapy of multiple cancers as an oncogene. Cell Cycle. 2021. V. 20. No. 21. P. 2291-2308. DOI: 10.1080/15384101.2021.1982494.
- Fäldt Beding A., Larsson P., Helou K., et al. Pan-cancer analysis identifies BIRC5 as a prognostic biomarker. BMC Cancer. 2022. V. 22. No. 1. Article ID 322. DOI: 10.1186/s12885-022-09371-0.
- MahmoodN., Mihalcioiu C., Rabbani S.A. Multifaceted role of the urokinase-type plasminogen activator (uPA) and its receptor (uPAR): diagnostic, prognostic, and therapeutic applications. Front Oncol. 2018. V. 8. Article ID 24. DOI: 10.3389/fonc.2018.00024.


