Взаимосвязь между пероксидным окислением липидов, активностью антиоксидантной системы защиты и содержанием веществ низкой и средней молекулярной массы при интоксикации животных ацетальдегидом
Автор: Степанова И.П., Дмитриева Л.М., Патюков А.Г., Мугак В.В., Конева И.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Обмен веществ и продуктивность
Статья в выпуске: 6 т.39, 2004 года.
Бесплатный доступ
Оценивали взаимосвязь между интенсивностью пероксидного окисления липидов, функциональным состоянием системы антиоксидантной защиты и концентрацией веществ низкой и средней молекулярной массы в плазме и эритроцитах крови при ацетальдегидной интоксикации белых крыс.
Короткий адрес: https://sciup.org/142133019
IDR: 142133019 | УДК: 636.028:577.125.33:577.121.7
Текст научной статьи Взаимосвязь между пероксидным окислением липидов, активностью антиоксидантной системы защиты и содержанием веществ низкой и средней молекулярной массы при интоксикации животных ацетальдегидом
Для диагностики нарушений метаболизма у крупного рогатого скота используют интегральный метод, основанный на определении содержания веществ низкой и средней молекулярной массы в плазме и эритроцитах крови (ВНСММ) (1). При разработке патогенетически обоснованных способов коррекции метаболических сдвигов у животных необходимо учитывать степень взаимосвязи между содержанием ВНСММ в крови, интенсивностью пероксидного окисления липидов (ПОЛ) и состоянием антиоксидантной системы (АОС), так как при активации процессов свободнорадикального окисления происходит запуск механизма каскадных реакций, вызывающих глубокие нарушения обмена веществ (2). В последние годы среди возможных причин метаболических нарушений и развития эндогенной интоксикации важная роль отводится такому соединению, как ацетальдегид, который является естественным метаболитом и присутствует в крови и тканях мозга млекопитающих, образуясь не только из эндогенного этанола, но и других субстратов (пируват, треонин, фосфоэтаноламин) (3). Значимость каждого из возможных способов образования ацетальдегида и его роль в метаболизме окончательно не выявлены. Существует гипотеза, что именно ацетальдегид, а не этанол, оказывает регуляторное воздействие на работу дыхательной цепи клетки посредством изменения структурнофункционального состояния убихинона. В то же время известно, что ацетальдегид является токсическим веществом, способным к образованию аддуктов с белками и нуклеиновыми кислотами, что сопровождается выработкой антител, инактивацией ферментов, нарушением репарации ДНК, кроме того, он снижает содержание восстановленного глутатиона и нарушает другие механизмы антиоксидантной защиты (4). Поэтому ацетальдегид в организме животных должен достаточно быстро окисляться, при этом необходимо участие систем детоксикации. Существует баланс между ферментативными реакциями синтеза и окисления ацетальдегида альдегиддегидрогеназами, представленными во всех тканях. Возможно, что уксусный альдегид также восстанавливается под влиянием редуктаз. В результате этих процессов содержание эндогенного ацетальдегида существенно снижается. В любой живой системе при избыточном поступлении токсических веществ может нарушаться процесс детоксикации, что влечет за собой образование в тканях ацетальдегида, сопровождающееся метаболическими нарушениями.
В задачу нашей работы входила оценка взаимосвязи между содержанием веществ низкой и средней молекулярной массы в плазме крови и эритроцитах, интенсивностью пероксидного окисления липидов и активностью антиоксидантной системы защиты при интоксикации белых крыс ацетальдегидом с целью выявления сдвигов в обмене веществ.
Методика. Объектом исследования служили половозрелые самцы крыс линии Вистар живой массой 260-300 г. Животным в опыте (n = 49) интрагастрально вводили 20 % раствор уксусного альдегида в дозе 14 ммоль/кг живой массы (половина LD50), в контроле (n = 15) — воду. Пробы крови отбирали, основываясь на фармакокинетике ацетальдегида, через 30 мин, 1, 2, 4, 6, 12 и 24 ч после интоксикации. Так, в течение первых 2 ч, как правило, происходит резорбция и метаболи- зация экзогенного вещества, а затем вовлечение в различные окислительные процессы. Через 24 ч такое реакционноспособное химическое соединение не оказывает непосредственного токсического влияния, но, инициируя ферменты первой фазы детоксикации, способствует ослаблению компенсаторноприспособительных реакций, что приводит к развитию патологических реакций.
Содержание ВНСММ в сыворотке крови и эритроцитах определяли по методу Малаховой (5) с использованием спектрофотометра СФ-46 и оценивали по площади фигуры (S), ограниченной спектральной кривой и осью абсцисс, при длине волны от 246 до 302 нм: S = 4∑D(246-302), где D — оптическая плотность (усл. ед.), 4 — шаг измерения.
Интенсивность ПОЛ и активность антиоксидантной системы защиты оцени- вали методом индуцированной хемилюминесценции сыворотки крови (хемилюми-нометр БХЛ-06М) — соответственно по сумме световых хемилюминесцентных вспышек в пробах сыворотки крови за 30 с и в относительных единицах тангенcа угла наклона кинетической кривой индуцированной хемилюминесценции (6). Статистическую обработку данных проводили с использованием критериев Стьюдента и Пирсона.
Результаты. Спектрограммы плазмы и эритроцитов крови крыс в контроле имели вид параболы с максимальным светопоглощением соответственно при λ = 282
и λ = 258 нм (рис. 1). При этом средняя оптическая плотность в плазме и эритроцитах крови составляла соответственно 0,16 и 0,31 усл. ед., а площадь спектрограмм варьировала от 5,37 до 7,37 и от 8,56 до 10,20 усл. ед.2
Рис. 1. Спектрограммы плазмы (1) и эритроцитов (2) крови интактных крыс линии Вистар.
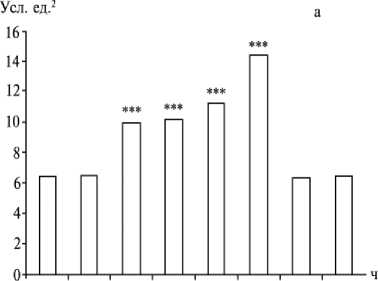
После введения ацетальдегида содержание ВНСММ в плазме крови подопытных животных через 30 мин было таким же, как в контроле, однако уже через 1 ч достоверно повышалось, достигая максимума через 6 ч, а через 12 ч возвращалось к норме (рис. 2, а). Средняя оптическая плотность при максимальном светопоглощении через 30 мин, 1, 2, 4, 6, 12 и 24 ч составляла соответственно 0,15; 0,25; 0,25; 0,29; 0,34; 0,16
и 0,15 усл. ед. (P > 0,05). Содержание ВНСММ в эритроцитах крови достоверно повышалось уже через 30 мин после введения ацетальдегида, сохранялось на этом уровне в течение 4 ч, а через 6 ч возвращалось к норме (рис. 2, б). Средняя оптическая плотность при максимальном све-топоглощении через 30 мин, 1, 2, 4, 6, 12
и 24 ч составляла соответственно 0,39; 0,38; 0,38; 0,35; 0,31; 0,30 и 0,34 усл. ед. (P <
0,05).
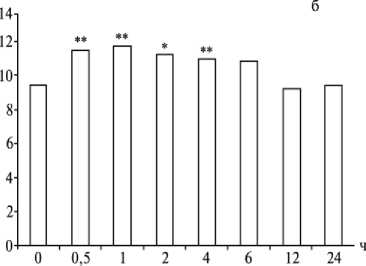
Рис. 2. Содержание (усл. ед. ) веществ низкой и средней молекулярной массы в плазме (а) и эритроцитах (б) крови крыс линии Вистар в зависимости от времени введения ацетальдегида (* P < 0,05; ** P < 0,01; *** P < 0,001).
Нами выявлена положительная линейная корреляция между содержанием ВНСММ в плазме и эритроцитах крови (коэффициент Пирсона 0,86; P < 0,001). В течение первых 6 ч после интрагастраль-ного введения ацетальдегида интенсивность накопления ВНСММ в плазме и сорбции этих соединений эритроцитами крови повышалась; через 12 ч метаболические процессы в крови животных нормализовались, что, вероятно, следует рассматривать как проявление общего адаптационного синдрома.
Сумма световых хемилюминесцентных вспышек в пробах сыворотки крови крыс в контроле варьировала в пределах от 10,35 до 11,53 ед. за 30 с (табл.). В течение первых 2 ч после токсического воздействия интенсивность ПОЛ была такой же, как в контроле, через 4 ч — достоверно повышалась, после чего оставалась на этом уровне в течение 8 ч, через 24 ч — практически нормализовалась.
Показатели интенсивности пероксидного окисления липидов и активности антиоксидантной системы защиты у крыс линии Вистар в зависимости от времени введе- ния ацетальдегида
|
Вариант опыта |
Сумма световых хемилюминесцентных вспышек, ед/30 с |
Тангенс угла наклона кинетической кривой индуцированной хемилюминесценции, отн. ед. |
|
До интоксикации (контроль) |
10,94 ± 0,76 |
0,14 ± 0,02 |
|
Время после интоксикации, ч: |
||
|
0,5 |
12,50 ± 1,44 |
0,17 ± 0,05 |
|
1 |
11,43 ± 0,78 |
0,14 ± 0,03 |
|
2 |
11,08 ± 1,39 |
0,12 ± 0,01 |
|
4 |
•15,37 ± 0,83** |
•0,25 ± 0,02** |
|
6 |
•14,13 ± 0,10** |
0,24 ± 0,003** |
|
12 |
12,29 ± 0,23* |
0,15 ± 0,02 |
|
24 |
11,32 ± 1,41 |
0,13 ± 0,006 |
|
* P < 0,05; ** P < 0,001. |
Тангенс угла наклона кинетической кривой индуцированной хемилюминесценции сыворотки крови у крыс в контроле составлял в среднем 0,14 отн. ед. (см. табл.). Активность АОС в течение 2 ч после введения ацетальдегида практически не изменялась, через 4 ч — достоверно увеличивалась, а через 12 ч — нормализовалась.
Полученные нами данные свидетельствуют о том, что в течение первых 6 ч после ацетальдегидной интоксикации повышается интенсивность ПОЛ и функциональная активность антиоксидантной системы защиты (максимальные изменения выявлены через 4 ч), затем обмен веществ нормализуется.
Обнаружена линейная взаимосвязь между интенсивностью ПОЛ и активностью АОС (коэффициент Пирсона 0,88; P < 0,001), между интенсивностью ПОЛ и содержанием ВНСММ в плазме и эритроцитах крови (коэффициент Пирсона соот- ветственно 0,89 и 0,90; P < 0,001), а также между активностью АОС и содержанием ВНСММ в плазме и эритроцитах (коэффициент Пирсона в обоих случаях 0,87; P < 0,001).
Таким образом, выявленную нами взаимосвязь между интенсивностью пероксидного окисления липидов, функциональной активностью антиоксидантной системы защиты и содержанием веществ низкой и средней молекулярной массы в плазме и эритроцитах крови рекомендуется использовать на практике с целью подбора патогенетически обоснованных методов коррекции метаболических сдвигов у животных различных видов, в том числе крупного рогатого скота.
Л И Т Е Р А Т У Р А
-
1. С т е п а н о в а И.П., В л а с о в а И.В., Д м и т р и е в а Л.М. Интегральный метод диагностики метаболических нарушений у коров. С.-х. биол., 2003, 4: 109-113.
-
2. В е л и ч к о в с к и й Б.Т. Свободнорадикальное окисление как звено срочной и долговременной адаптации организма к факторам окружающей среды. Вест. РАМН, 2001, 6: 45-52.
-
3. П р о н ь к о П.С., С а т а н о в с к а я В.И., Г о р е н ш т е й н Б.И. и др. Влияние пирувата, треонина и фосфоэтаноламина на обмен эндогенного ацетальдегида у крыс с токсическим поражением печени. Вопр. мед. хим., 2002, 48, 3: 278-285.
-
4. F e i h m a n L., L i e b e r C. Ethanol and lipid metabolism. Am. J. Clin. Nutr., 1999, 70: 791-792.
-
5. М а л а х о в а М.Я. Метод регистрации эндогенной интоксикации. СПб, 1995.
-
6. В л а д и м и р о в Ю.А. Свободные радикалы и антиоксиданты. Вест. РАМН, 1998, 7: 43-51.
Институт ветеринарной медицины Омского ГАУ,


