Железодефицитная анемиия (обзор литературы)
Автор: Романенко Н.А.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Обзор литературы
Статья в выпуске: 1 т.20, 2024 года.
Бесплатный доступ
Железодефицитная анемия (ЖДА) является частым приобретенным заболеванием, обусловленное снижением содержания железа в сыворотке крови, костном мозге и депо, приводящее к нарушению образования гемоглобина и эритроцитов с развитием гипохромной анемии и нарушений трофики тканей. В настоящей лекции даны общие понятия о биологической роли железа, его кинетике и регуляции в организме. Детально представлены причины дефицита железа, основные аспекты патогенеза, а также приведена современная классификация ЖДА. Подробно дано описание клинической картины с акцентом на симптомах латентного дефицита железа и самой анемии, а также на диагностике и дифференциальной диагностике с другими заболеваниями, сопровождающимися гипохромной анемией и сидеропеническим состоянием. Детально изложены вопросы терапии с использованием препаратов для энтерального и парентерального применения, показан расчет необходимой дозы железа в зависимости уровня гемоглобина, а также рассмотрен вопрос коррекции анемии с помощью трансфузий эритроцитов. Особое внимание уделено мерам профилактики у определенных категорий людей, имеющих риск развития ЖДА. Лекция представляет интерес для врачей различных специальностей, включая гематологов, трансфузиологов, терапевтов, педиатров, хирургов, акушеров-гинекологов, анестезиологов-реаниматологов и др., повышающих квалификацию, а также - для клинических ординаторов, аспирантов и студентов медицинских вузов.
Железодефицитная анемия, гемоглобин, ретикулоциты, гипохромия, эритроцит, препараты железа, сывороточный ферритин, сывороточное железо, дефицит железа
Короткий адрес: https://sciup.org/170204355
IDR: 170204355
Текст обзорной статьи Железодефицитная анемиия (обзор литературы)
Железодефицитная анемия (ЖДА) является частым приобретенным заболеванием, обусловленным снижением содержания железа в сыворотке крови, костном мозге и депо, приводящее к нару- described in detail, the calculation of the required dose of iron depending on the level of hemoglobin is shown, and the issue of correcting anemia with the red blood transfusions is also considered. Particular attention is paid to preventive measures in certain categories of people at risk of developing IDA.
The lecture is of interest to doctors of various specialties, including hematologists, transfusiologists, internists, pediatricians, surgeons, obstetricians, gynecologists, anesthesiologists-resuscitators, etc., who improve their qualifications, as well as for clinical residents, graduate students and students of medical universities.
ЖДА выявляется в любой возрастной категории людей – от периода новорожденности до глубокой старости. Также ЖДА почти с одинаковой частотой наблюдается у лиц мужского и женского пола, хотя в фертильный период начиная с пубертата и до менопаузы превалируют женщины, что обусловлено естественной циклической кровопотерей в период месячных.
Важно подчеркнуть, что ЖДА относится к дефицитным анемиям, следовательно, это группа анемий гипорегенераторного типа, отличительной чертой которых является значительное снижение числа ретикулоцитов (ретикулоцитопения), а в тяжелых случаях может выявляться нейтропения и/ или умеренная тромбоцитопения. В то же время при назначении препарата железа у пациента будет сопровождаться ретикулоцитарным кризом нередко с увеличением их содержания более 50–150‰, что может быть полезным при дифференциальной диагностике с другими анемиями, например, анемий вследствие дефицита белков и аминокислот, а также других веществ (медь, кобальт, витаминов группы В), участвующих в кроветворении, от анемий связанных с нарушением синтеза порфиринов (протопорфирия, порфирия, отравление свинцом) и т.п. Характерной особенностью железодефицита является то, что даже при отсутствии анемии у пациентов часто наблюдаются сидеропенические симптомы, нарушение трофики слизистых, кожи, изменения вкусовых приоритетов, нарушения толерантности к физической нагрузке, что обусловлено дефицитом ферментов, в состав которых входит железо [1, 2].
Железодефицитные состояния по Международной статистической классификации болезней, связанных со здоровьем (МКБ-10), подразделяют на ниже следующие (Таблица 1):
Таблица 1.
Классификация железодефицитных состояний по МКБ-10
|
Код МКБ-10 |
Нозологическая форма |
|
D 50 |
Железодефицитная анемия (сидеропеническая, гипохромная) |
|
D 50.0 |
Железодефицитная анемия вторичная, вследствие потери крови (хроническая, постгеморрагическая хроническая анемия) |
|
D 50.1 |
Сидеропеническая дисфагия (синдром Келли-Патерсона и синдром Пламмера-Винсона); |
|
D 50.8 |
Другие железодефицитные анемии |
|
D 50.9 |
Железодефицитная анемия неуточненная |
|
D 63.0 |
Анемия при новообразованиях |
|
D 63.8 |
Анемия при хронических болезнях, классифицированных в других рубриках |
|
E 61.1 |
Недостаточность железа |
|
O 99.0 |
Анемия, осложняющая беременность, деторождение и послеродовый период |
Важно подчеркнуть, что в группу железодефицитных состояний в ряде случаев можно отнести, как: D 63.0 – Анемия при новообразованиях, D 63.8 – Анемия при хронических болезнях, классифицированных в других рубриках, E 61.1 – Недостаточность железа (латентный дефицит железа) и O 99.0 – Анемия, осложняющая беременность, деторождение и послеродовый период. При этих состояниях патогенез анемии более сложный, комплексный и может сочетаться с функциональным дефицитом железа особенно при анемии хронического или опухолевого заболевания [3].
Кинетика железа и его регуляция
Известно, что в организме здорового человека содержится 4–5 г железа; из них приходится на ге- моглобин (в составе гема) порядка 50%, т.е. в циркулирующих эритроцитах – 2000–2500 мг железа. Остальная часть его содержится в миоглобине (300 мг или 7–8%), связана с тканевыми ферментативными системами (300 мг или 7–8%) и в виде запасов депо: в печени (500–1000 мг или 10–20%), в костном мозге (300 мг или 7–8%), в ретикулоэндотелиальной системе в макрофагах (до 500 мг или 10–12%). При этом важно подчеркнуть, что в 1 мл «чистых» эритроцитов (без плазмы) содержится около 1,08 г железа, следовательно в 1 мл крови с гематокритом 48–50% в норме содержание железа составляет 0,5 мг. Это необходимо учитывать особенно в категории доноров крови, а также при небольших объемах кровопотери, но длящихся в течение нескольких месяцев или лет, например, из эрозии слизистой тонкой кишки, геморрое, фибромиоме.
Важно подчеркнуть, что суточная потребность в железе составляет порядка 22–24 мг. Эта потребность обеспечивается практически полностью за счет образующегося при распаде старых собственных эритроцитов (из гема гемоглобина). Однако в ходе жизнедеятельности организма происходит в небольших количествах (1-1,5 мг в сутки) потеря этого микроэлемента (десквамация эпителия, mensis, мелкие кровотечения) и, чтобы не возникло дефицита железа, оно должно пополняться за счет энтерального поступления с пищей. Так, из продуктов питания у здорового человека в течение суток всасывается максимум 2,0–2,5 мг, хотя с пищей поступает более 15–20 мг микроэлемента. Однако при железодефицитном состоянии всасывание его возрастает приблизительно в 3 раза, составляя 5–6 мг в сутки. Процесс всасывания железа у человека жестко регулируется ферментативными системами, не допускающими перегрузки железа (механизмов выведения железа в организме нет). Поэтому бóльшее количество микроэлемента, чем требуется организму, алиментарным путем не будет усвоено [4].
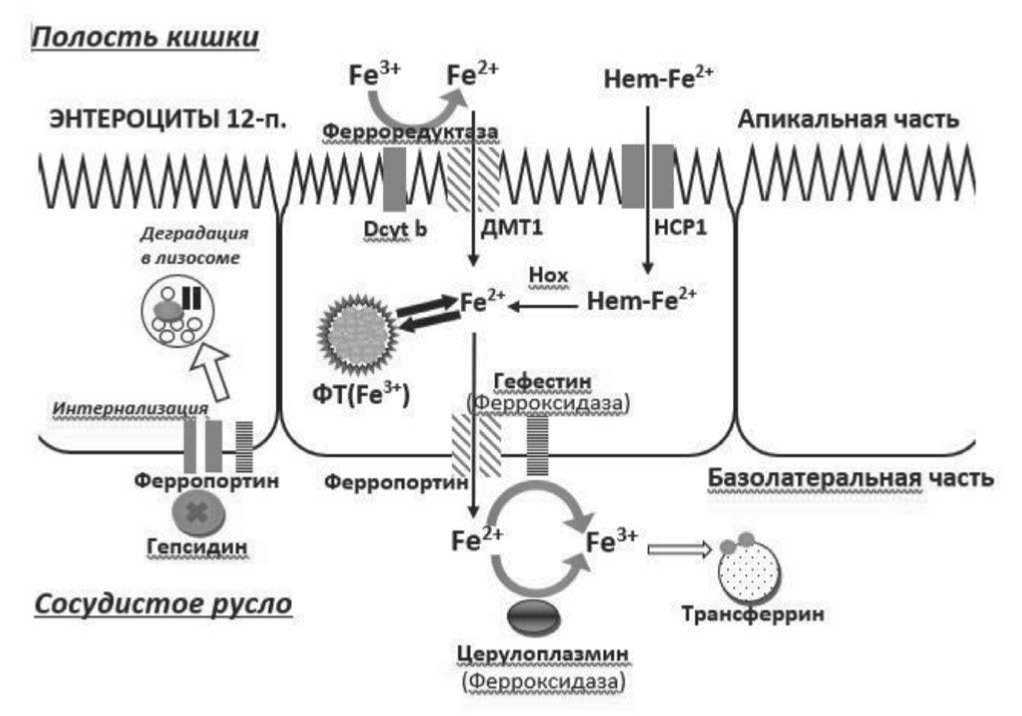
Рисунок 1. Схема всасывания железа в энтероците двенадцатиперстной кишки [5]
Далее, с помощью белка ферропортина железо транспортируется в плазму крови. При этом, часть железа еще внутри клетки из двухвалентного под действием гефестина окисляется до трехвалентного, а другая его часть окисляется в плазме с помощью церулоплазмина. Оба белка – церулоплазмин, гефестин – относятся к ферроксидазам. В любом случае в плазме микроэлемент должен быть трехвалентным. Если ионы железа (Fe2+) находятся в свободном состоянии в плазме, т.е. не связанны с транспортными белками или не входят в состав молекул ферментов или гемоглобина, то они обладают токсическим эффектом, вызывая перекисное окисление мембран. Поэтому при переходе железа из клетки в кровь транспортным белком трансферрином захватываются (по два атома железа на каждый) и транспортируются к клеткам мишеням (эритробластам костного мозга) или в депо. На эритробластах экспрессируются трансферриновые рецепторы, с помощью которых железо захватывается и путем пиноцитоза переносится в клетку-мишень. Важно подчеркнуть, что количество трансферриновых рецепторов существенно возрастает на поверхности эритроидных клеток при железодефицитном состоянии. Они могут попадать в растворенном состоянии в сыворотку крови. Их можно определить с помощью иммунотурбодиметрического метода или иммуноферментным анализом – растворимые трансферриновые рецепторы (sTfR). sTfR нередко используют в трудных случаях диагностики железодефицитного состояния [5].
Железо идет на синтез гема, нуклеиновых кислот, железосодержащих энзимов. Неутилизирован-ное («лишнее») железо соединяется с ферритином, являющимся одновременно транспортным белком и белком-депо и может на себе нести до 5000 атомов железа, в то время как трансферрин – лишь два.
Основным регулятором железа в организме является гормон гепсидин, синтезируемый клетками печени. Его содержание меняется в зависимости от уровня лабильного железа в сыворотке крови: поскольку он является отрицательным регулятором, при повышении железа в крови увеличивается синтез этого гормона, который вступает во взаимодействие с ферропортином, образуя комплекс «ферро-портин-гепсидин», в результате чего ферропортин перестает переносить ионы железа из клетки в кровоток и подвергается деградации (Рис. 1). Иными словами, гепсидин является обратным регулятором железа. Его основная роль в организме – не допустить избытка железа, а при микробном воспалении – удалить железо из крови, так как оно играет важную роль в жизнедеятельности микроорганизмов (патогенов), и при его снижении нарушается деление бактерий. И наоборот, при дефиците железа синтез гепсидина падает и ферропортин беспрепятственно переносит железо в кровоток. Антагонистом гепсидина и в то же время положительным регулятором железа является эритроферрон, который синтезируется клетками эритрона костного мозга. При снижении железа в сыворотке крови количество эритроферрона возрастает, что блокирует синтез гепсидина и, в конечном итоге, повышается всасывание железа в кишечнике, а кроме того, облегчается выход его из депо в кровоток [6]. Его количество также увеличивается при кровотечении и при введении гормона эритропоэтина.
Биологическая роль железа в организме
Известно, что железо входит в состав гемоглобина – в структуру молекулы гема, осуществляя перенос кислорода тканям. В легких кислород, диффундируя из просвета в капилляр (в кровоток), захватывается атомами железа и переносится в ткани, т.е. восстановленный гемоглобин, в составе которого Fe2+, присоединяет с О2, окисляясь до Fe3+, транспортирует кислород в ткани. В тканях происходит отдача кислорода и восстановление железа до Fe2+. Иными словами, ценность железа заключена в транспорте кислорода и снабжении им органов и тканей.
Помимо переноса кислорода железо принимает участие в процессах тканевого дыхания, оно входит в состав боле чем половины различных энзимов цикла Кребса и его кофакторов, принимая участие в ферментативном окислении глюкозы до СО2 и H2O с получением 38 молекул АТФ. Наличие железа в клетках мозга важно для окончаний нейронов, которые синтезируют γ-аминомасляную кислоту; при снижении Fe происходит нарушение деградации гамма-аминомасляной кислоты и нарушается функционирование нейронов, синтезирующих дофамин. Кроме того, железо необходимо для кроветворения (не только эритрона, но и миелоидной и лимфоидной ткани), синтеза гормонов щитовидной железы, катехоламинов, коллагена, поддержания иммунной системы (фагоцитоз, естественные киллеры, белки системы комплемента, лизоцим, интерфероны, иммуноглобулины класса А), играет роль в росте и старении клеток, а также оно вовлечено в различные процессы активации и ингибирования целого ряда ферментов и т.п. Поэтому, если возникает недостаток железа в организме, то происходит не только хроническая гипоксия тканей, обусловленная снижением кислорода, но и масса нарушений в клетках и тканях, где задействовано железо [5, 7].
Этиология и патогенез железодефицитного состояния и анемии
Среди причин развития железодефицита в организме человека выделяют следующие группы:
-
- недостаточное поступление в организм с пищей;
-
- нарушение всасывания железа (патология желудочно-кишечного тракта);
-
- хронические кровопотери (при опухолях, маточные и язвенные);
-
- повышенное потребление (во время роста и развития ребенка, в период лактации, при интенсивной нагрузке у спортсменов).
-
1. Причиной недостаточного поступления железа в организм с пищей может быть голодание, диета, не содержащая в пищевых продуктах достаточного количества железа, например, диета без мяса. Важно подчеркнуть, что железо содержится в большинстве продуктов животного и растительного происхождения. Однако биодоступность железа во фруктах, овощах крайне низкая, поэтому оно плохо всасывается в пищеварительном тракте. В то же время в мясных продуктах, особенно в говядине, баранине, свинине, в печенке, в почках содержится довольно много гемового железа, которое хорошо усваивается и быстро восстанавливает дефицит в организме.
-
2. Частой причиной нарушения усвоения железа является патология желудочно-кишечного тракта или прием пищи с некоторыми лекарствами. Если у пациента ахилия при хронических атрофических гастритах (Helicobacter P.), или имеются рубцы, воспаления в двенадцатиперстной кишке или проксимальном отделе тощей кишки (дуоденит, энтерит), синдром мальабсорбции, глютеновая энтеропатия, спру, болезнь Крона, злокачественные новообразования верхних отделов ЖКТ (желудок, двенадцатиперстная кишка), то часто развивается железодефицитное состояние. При наличии вышеперечисленных заболеваний у больных очень плохо происходит его восполнение даже на фоне приема препаратов железа.
-
3. Хроническая кровопотеря – это одна из наиболее частых причин дефицита железа. Здесь речь идет не об острой кровопотере (хотя она может тоже приводить к дефициту железа), а о хронической, когда ежедневно теряется по несколько мл крови. При этом хроническая кровопотеря может быть явной с потерей крови > 50 мл в день, что может быть: а) замечено даже самим пациентом, например, кровь в стуле, маточные кровотечения; б) скрытой кровопотерей, при которой теряется менее 5-15 мл в течение суток, но за год составит около 1,5–5,5 л крови. Микрогеморрагический синдром, нередко, не представляется возможности выявить с помощью тестов на скрытую кровь, например, реакцией Грегерсена или аналогичной, а требует проведения более тонких методов диагностики, например, видеокапсуль-ной эндоскопии.
Среди кровопотерь можно выделить:
сплетения, при наследственной тлеагиэктазии, при тромбоцитопатиях или тромбоцитопениях);
-
4) легочные (кордароновый пульмонит, кровохарканье при опухолях, туберкулезе, буллы);
-
5) почечные;
-
6) после экстракции зубов;
-
7) кровотечения в закрытые полости, когда не обнаруживается видимого кровотечения при эктопическом эндометриозе (эктопическое разрастание эндометрия: излившееся с кровью железо не используется на эритропоэз, а теряется); аналогично к потере железа приводит изолированный легочный гемосидероз, гемолитические опухоли, возникающие в замыкающихся артериях и встречающиеся в некоторых артерио-венозных анастомозах, например, в легких, плевре;
-
8) у доноров крови, особенно при повторных кроводачах (эксфузия одной дозы крови составляет 450–480 мл крови, что соответствует 200–250 мг железа, а при четырехкратной сдаче крови на протяжении одного года потеря этого микроэлемента из организма составит около 800–1000 мг);
-
9) гематурии различного происхождения (хронический гематурический нефрит, IgA-нефропатия, мочекаменная болезнь, перманентный внутрисосудистый гемолиз), а также у больных хронической почечной недостаточностью, находящихся на гемодиализе (в закрытом контуре) потеря железа достигает 15–30 мг за одну процедуру или до 120–250 мг в месяц (равной половине или целой дозы крови при одной кроводаче у донора);
-
10) ятрогенные кровопотери (частые многократные эксфузии крови для исследований), кровопускания (при истинной полицитемии или вторичных эритроцитозах) [1].
-
4. Расход преобладает над поступлением. Причина такого железодефицитного состояния характерна больше для: а) лиц, имеющих высокую физическую нагрузку (спортсмены, тяжелые работы); б) в период интенсивного роста (на первом году жизни – происходит увеличение массы тела ребенка в 3 раза, а также в подростково-юношоский период); в) у женщин во время беременности и кормления грудью (теряется железо на рост плода в количестве 350 мг и плацентарную кровь – 200 мг, кровопотеря в родах – 50–100 мг, грудное вскармливание – 450 мг, что в целом составляет 1000–1200 мг железа).
В патогенезе ЖДА играет роль снижение железа в крови и депо, что ведет к:
-
1) снижению синтеза гема и образования гемоглобина с развитием анемии и гипоксии тканей, синтеза миоглобина;
-
2) снижению синтеза железосодержащих ферментов тканей с последующим поражением эпителиальных тканей и: а) атрофией слизистых оболочек, прежде всего пищеварительного тракта, нарушая всасывание железа, б) трофическим поражениям кожи и ее дериватов, в) гипоксии тканей;
-
3) нарушению синтеза железосодержащих соединений, участвующих в окислительно-восстановительных реакциях (цитохромы, пероксидазы), снижение антиоксидантных факторов, что приводит к усилению липопероксидации (усилению перекисного окисления) и повреждению мембран с последующим их лизисом, т.е. укорочением их жизни, что усугубляет анемию [1, 2, 5].
Особым образом отличается анемия онкологического заболевания. Данный тип анемии, как правило, носит комплексный генез. Он может включать в себя хронический микро- или макрогеморрагиче-ский синдром, приводящий к железодефицитной анемии, супрессивное воздействие провоспали-тельных цитокинов в ответ на опухоль с развитием функционального железодефицита, недостаточную продукцию эндогенного эритропоэтина, гипоплазию красного кроветворного ростка костного мозга за счет вытеснения его опухолевыми элементами, а также токсический эффект цитостатических химиопрепаратов, что может усугубляться развитием постцитостатической двух- или трехростковой ци-топенией [3, 8]. Важно подчеркнуть, что в данной ситуации часто присутствует железодефицит и его необходимо корригировать препаратами железа в комплексе с эритропоэзстимулирующей терапией или трансфузиями эритроцитов [3].
Эпидемиология
Железодефицитная анемия относится к самому распространенному заболеванию в мире и стоит на первом месте по частоте встречаемости у женщин детородного возраста, особенно у беременных [1]. Нередко выделяют предлатентный, латентный и манифестный дефициты железа [7]. Предлатент-ный дефицит железа – это состояние, обусловленное снижением запасов железа, но без уменьшения его расходов на эритропоэз; латентный дефицит железа – это полное истощение запасов этого микроэлемента в депо, но без признаков анемии; манифестный дефицит железа – это снижение гемоглобина, сопровождающееся признаками анемии.
В целом железодефицитные состояния встречаются приблизительно в 2–5 раз чаще, чем сама ЖДА. При этом частота последней варьирует в широких пределах, составляя от 2–59% в популяции. Во многом на частоту ЖДА влияют социально-экономические условия жизни, сбалансированное полноценное питание, пол, возраст, раса, наличие сопутствующей патологии (особенно сопровождающейся кровотечениями, например, язвенная болезнь, солидная опухоль, фибромиома матки, патологии гемостаза), местность, на которой проживает пациент.
Так, у взрослых мужчин частота ЖДА в развитых странах составляет лишь 2%, в развивающихся – 26%, у женщин в развитых странах – 11%, в развивающихся – 47%. При этом у беременных женщин в развитых странах – 14%, в развивающихся – 56% [1].
В детской популяции частота ЖДА еще больше зависит от социально-экономических условий. Так, если в развитых странах у детей ЖДА в возрасте 5-12 лет составляет около 7%, то в развивающихся доходит до 46%. Более того, среди всех разновидностей анемий у детей железодефицитные составляют 90%.
Учитывая такую высокую распространенность ЖДА в зависимости от ее частоты экспертами ВОЗ принято подразделять на умеренную распространенность < 20%, среднюю – от 20% до 39,9% и высокую – > 40% [1].
Клиника
При рассмотрении клинической картины ЖДА следует выделить такое состояние, как латентный дефицит железа и собственно железодефицитную анемию, характеризующуюся сидеропеническим и анемическим синдромами.
Латентный дефицит железа может протекать бессимптомно или сопровождаться общими симптомами, не имеющих специфической окраски. Он характеризуется умеренной слабостью, снижением работоспособности, недомоганием, а при длительном течении – склонностью к частым инфекциям; у детей – к нарушению психомоторного и физического развития, снижению способности к обучению, познавательной деятельности. Латентный дефицит, главным образом, характеризуется незначительным снижением относительно нижней границы нормы в гемограмме цветного показателя, эритро-цитных индексов, без снижения гемоглобина, а при биохимическом исследовании – снижением уровня сывороточного ферритина и сывороточного железа.
Сидеропенический синдром обусловлен снижением активности железосодержащих ферментов. Он характеризуется теми же симптомами, что и латентный дефицит, но в более выраженной форме, сопровождаясь:
-
- извращением вкуса (желание есть землю, мел, или иные несъедобные продукты, запах бензина им кажется приятным и т.д.);
-
- симптомом Плюммера-Винсона (нарушение глотания с ощущением инородного тела в горле);
-
- «малыми симптомами дефицита железа» – атрофией сосочков языка (язык может быть географическим) с чувством его распирания, трещиной языка, хейлитом («заеды»), сухостью кожи, выпадением волос, ломкостью ногтей или их слоистостью;
-
- мышечной слабостью – очень характерный сидеропенический симптом, который может сопровождаться даже энурезом (недержанием мочи);
Может встречаться синдром «беспокойных ног».
Важно подчеркнуть, что цвет кожных покровов у пациентов очень типичен: имеет бледновато-зеленоватый оттенок (хлороз).
Анемический синдром, характеризуется прежде всего снижением гемоглобина и гематокрита в гемограмме, а также:
-
- снижением толерантности к физической нагрузке, привычной для повседневной жизни;
-
- тахикардией и тахипноэ (компенсаторно – особенно усиливающейся при физической нагрузке);
-
- гипотонией, характеризующейся шумом в ушах, головокружением, потемнением в глазах при принятии вертикального положения из горизонтального (ортостатическая проба);
-
- бледностью с зеленоватым оттенком;
-
- аускультативно – «шумом волчка» на яремной вене, шумом в проекции легочной артерии (характерно при снижении уровня гемоглобина ниже 90 г/л);
-
- субфебрильной лихорадкой.
Клиническая картина ЖДА становится более яркой по мере снижения гемоглобина, однако тяжесть состояния больного не всегда ассоциирована с уровнем гемоглобина. Иногда на прием к врачу приходят пациенты с содержанием гемоглобина в крови менее 50-60 г/л, и при этом они отмечают лишь умеренные жалобы, в то же время другие больные с гемоглобином 100-110 г/л имеют яркую клиническую симптоматику.
Важно подчеркнуть, что при длительном течении ЖДА у больных могут возникнуть такие осложнения как:
-
- дефицит противоинфекционного иммунитета вследствие нарушения клеточных механизмов ответа на внедрение инфекции (снижение бактерицидной активности гранулоцитов, нарушение пролиферации лимфоцитов, снижение подвижности и активности макрофагов) [2, 4, 7].
Классификация железодефицитной анемии по степени тяжести
В практической деятельности врача обычно пользуются классификацией в зависимости от уровня гемоглобина, подразделенную на 3 степени тяжести, которая применима для острой анемии в результате кровопотери, для хронической анемии, имеющей любой генез, в том числе дефицит железа:
-
- I-я степень (легкая) – уровень гемоглобина 90– 119 г/л для женщин и 90–129 г/л для мужчин;
-
- II-я степень (средняя) – уровень гемоглобина 70–89 г/л;
-
- III-я степень (тяжелая) – уровень гемоглобина менее 70 г/л.
Однако с 2011 года ВОЗ предложена новая классификация именно для ЖДА, отличающаяся от других [9]. Эта классификация подразделяет анемии на три степени тяжести в зависимости от уровня гемоглобина (Таблица 2).
Таблица 2
Классификация железодефицитной анемии в зависимости от степени тяжести
|
Степень тяжести анемии |
Уровень гемоглобина (г/л) |
|
|
Основная популяция пациентов |
Беременные |
|
|
I-я (легкая) |
110–119 |
100–109 |
|
II-я (средняя) |
80–109 |
70–99 |
|
III-я (тяжелая) |
< 80 |
< 70 |
Важно подчеркнуть, что у беременных пациентов уровень гемоглобина считается на 10 г/л ниже, чем в общей популяции больных. Кроме того, тяжелую степень ЖДА в соответствии с этой классификацией следует рассматривать уже при уровне гемоглобина менее 80 г/л, так как при данном виде анемии по мимо гипоксии, обусловленной низким уровнем гемоглобина, имеет место и дефицит многих ферментов, в том числе участвующих в окислительновосстановительных процессах, переносе кислорода, в состав которых входит данный микроэлемент – железо [2, 7].
Диагностика железодефицитной анемии
Основная роль в диагностике ЖДА принадлежит клиническому анализу крови (гемограмме) с подсчетом ретикулоцитов и некоторым биохимическим параметрам. Однако на этом диагностический поиск не должен завершаться, так как ряд дополнительных инструментальных и лабораторных методов позволяют доказать дефицит железа, с одной стороны, и определить его причину – с другой. Ниже приводятся наиболее ценные исследования.
-
1. В гемограмме выявляется гипохромная микроцитарная анемия (снижение гемоглобина при нормальном или сниженном числе эритроцитов),
-
2. К наиболее диагностически важным биохимическим изменениям относятся:
снижение цветового показателя (ниже 0,7). Характерен микроцитоз со снижением среднего объема эритроцитов – MCV (mean corpuscular volume; норма – 80–100 фл /1 фл = 1×10-15л/), гипохромия со снижением среднего содержания гемоглобина в эритроците – MCH (mean corpuscular hemoglobin; норма – 27–31 пг / 1 пг = 1×10-12г/), анизохромия (разные размеры эритроцитов, т.е. увеличение RDW – red cell distribution width – ширина распределения эритроцитов по объему), пойкилоцитоз (разные формы эритроцитов). При этом количество ретикулоцитов при глубоком дефиците железа снижено или находится в пределах нормы (норма – 2–10‰) Однако при лечении препаратами железа число их резко возрастает, нередко более 50‰. У больных с хроническими кровопотерями часто увеличивается и число тромбоцитов выше нормы (норма – 150– 400×109/л), так называемый, – реактивный тромбоцитоз. Важное значение в дифференциальной диагностике имеет описание мазка крови, где морфолог может обратить внимание на анизоцитоз, гипохромию эритроцитов, изменение их формы (пойкило-цитоз).
-
- снижение сывороточного железа менее 9 мкмоль/л (норма – 9–30 мкмоль/л),
-
- снижение коэффициента насыщения трансфер-
СРБ* - С-реактивный белок
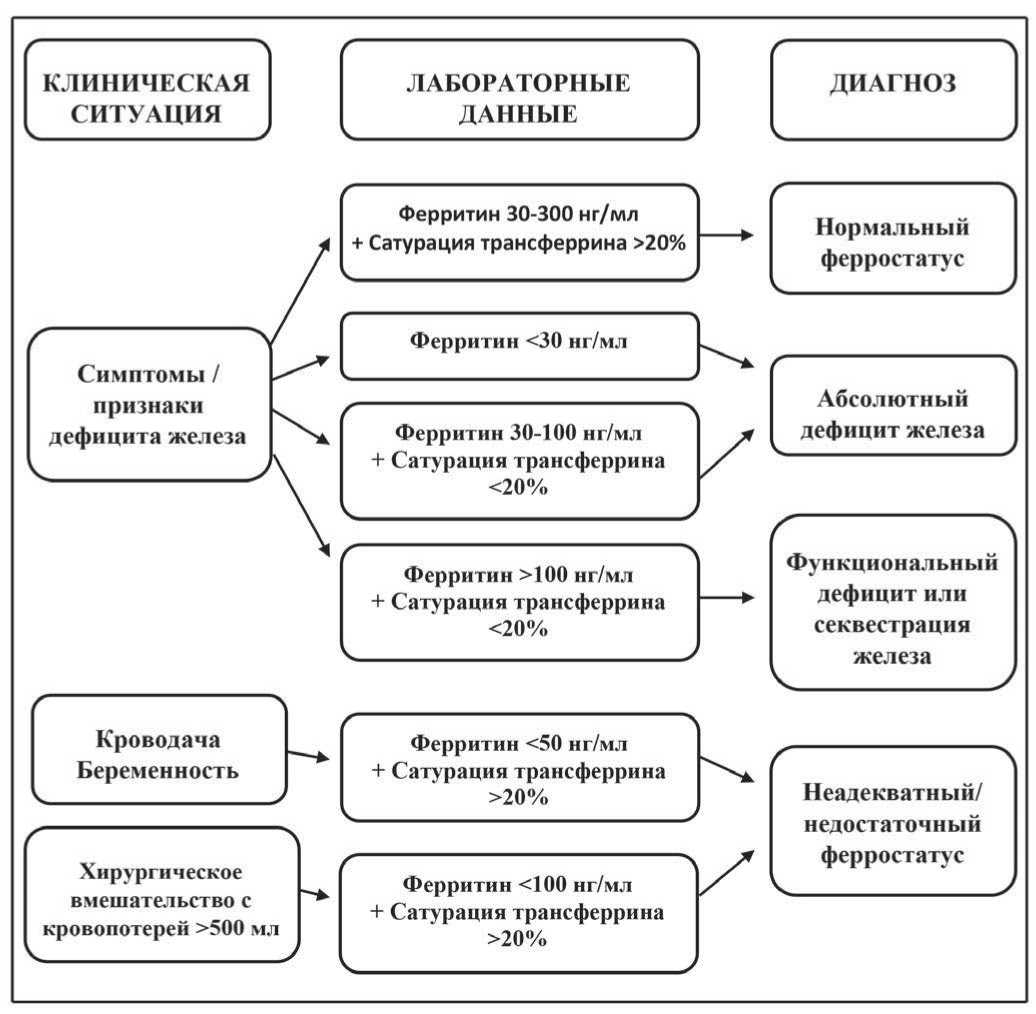
Рисунок 2. Диагностика железодефицитного состояния [10]
рина железом – TSAT менее 20% (норма – 20–50%),
-
- снижение сывороточного ферритина менее 30 нг/мл (норма у женщин 20–150 нг/мл, у мужчин 30–340 нг/мл),
-
- увеличение общей железосвязывающей способности – ОЖСС (норма – 20–65 мкмоль/л),
-
- увеличение латентной железосвязывающей способности – ЛЖСС,
-
- повышение трансферрина (норма – 2–4 г/л),
-
- увеличение содержания растворимых трансферриновых рецепторов – sTfR (2–5 нг/мл). Важно отметить, что sTfR исследуют редко – в основном для дифференциальной диагностики. Для удобства приводится алгоритм диагностики железодефицитного состояния.
-
3. Исследование костного мозга при ЖДА проводится крайне редко, лишь при подозрении на гемобластоз или метастазирование раковыми клетками. В миелограмме при дефиците железа отмечается гиперплазия костного мозга с эритробластозом до 40–60%, имеющие «голые ядра». Однако в тяжелых случаях костный мозг может быть и угнетен.
-
4. Инструментальные методы позволяют не диагностировать ЖДА, а выявить у большей части пациентов ее причину (источник кровотечения или нарушения всасывания). При первичном выявлении ЖДА рекомендуется по показаниям провести рентгенографию или КТ, или МРТ органов грудной клетки, УЗИ органов брюшной полости, забрюшинного пространства, малого таза, щитовидной железы, ЭКГ, проведение эзофагогастродуоденоскопии, колоноскопии, КТ-колоноскопии, интестиноскопии для обнаружения источника кровотечения, прежде всего, пациентам мужского пола и женщинам в постменопаузе, а также, если женщина в репродуктивном возрасте, но возникновение у нее ЖДА не связано с месячными или родами и кормлением грудью. При недоступности колоноскопии или невозможности ее проведения выполняют КТ-колоноскопию или видеокапсульную колоноскопию. Если не определен источник кровотечения в верхнем и нижнем этажах ЖКТ, то проводят интестиноскопию (эндоскопическое исследование тонкой кишки с помощью виде-окапсульной интестиноскопии).
Трудные для диагностики кровопотери в замкнутые полости при эндометриозе, изолированном легочном сидерозе, гемолитических опухолях, возникающих в замыкающихся артериях и встречающихся в некоторых артерио-венозных анастомозах, например, в легких, плевре. Эти опухоли, особенно при изъязвлении, могут приводить к кровопотерям и развитию ЖДА, а для их выявления нередко требуются специальные методы обследования у конкретных специалистов. Также необходимо помнить, что причиной кровопотерь могут быть носовые кровотечения при геморрагических диатезах (наследственная телеангиэктазия, иммунная тромбоцитопения, тромбоцитопатия, коагулопатия и др.), что требует исследование коагулограммы, функциональной активности тромбоцитов и т.п. В то же время при целиакии, приводящей к нарушению всасывания железа, необходимо исследовать содержание антител к тканевой трансглютаминазе или к эндомизию в крови [1, 2, 7].
Дифференциальная диагностика
Железодефицитную анемию необходимо дифференцировать с рядом заболеваний, характеризующихся анемией, микроцитозом и гипохромией эритроцитов. Среди таких заболеваний являются следующие:
-
- врожденная гемолитическая анемия – талассемия. Для данного заболевания также характерен микроцитоз с резким уменьшением MCV (нередко менее 55–60 фл), иногда – гипохромия, но с мишеневидными эритроцитами и высоким уровнем ретикулоцитов. Характерно снижение индекса Менцера < 13 (соотношение MCV к количеству эритроцитов), в то время как для ЖДА он обычно более 13. Для талассемии, как правило, выявляется повышенный или нормальный уровень сывороточного железа и ферритина, при электрофорезе определяется увеличение содержания фетального гемоглобина – HbF и HbA2, а при опросе пациенты отмечают, что назначаемая терапия препаратами железа была неэффективной, а также наличие семейного анамнеза по анемии [11];
-
- сидеробластная (сидероахрестическая) анемия врожденная (Х-сцепленная с нарушением гена, переносящего железо к гемоглобину и митохондриальная цитопатия) или приобретенная (при МДС, при онкологических и аутоиммунных заболеваниях). При сидеробластной анемии характерно отложение железа в тканях, а для синтеза гема эритроцитов этого микроэлемента не хватает; для ее диагностики требуется исследование пунктата костного мозга, позволяющее определить высокое содержание сидеробластов, также исследуется уровень ферритина в крови, и сывороточного железа;
-
- анемия при хроническом отравлении свинцом относится к гипохромным сидеробластным анемиям. В костном мозге характерно увеличение содержания сидеробластов, в крови – наличие сидероци-тов, анемия при этом гипохромная, но содержание железа повышено. В основе патогенеза анемии лежит блокада свинцом ферментов, участвующих в синтезе гема;
-
- анемия хронического заболевания и анемия при новообразовании: в обоих случаях патогенез носит комплексный характер, но основная роль принадлежит супрессивному эффекту провоспа-лительных цитокинов (ФНО-α, интерлейкинам -6, -1β, интерферону-γ), которые ведут к угнетению эритропоэза, относительному снижению синтеза эритропоэтина, увеличению синтеза гепсидина, который нарушает всасывание железа в кишечнике
и выходу его из депо, приводя к функциональному дефициту железа. Анемия характеризуется гипохромией с нормоцитозом и часто высоким уровнем ферритина, в то время как сывороточное железо и трансферрин снижены или в норме. Для дифдиагно-стики помогает исследование растворимых трансферриновых рецепторов [1, 11].
Лечение
После постановки диагноза и определения степени тяжести необходимо решить вопрос о терапии. Лечение подразделяют на медикаментозное и диетотерапию. Последняя способствует коррекции дефицита железа при употреблении продуктов богатой гемовым железом, которое максимально содержится в говядине, баранине, свинине, говяжьей и свиной печенке, несколько меньше его содержится в курином мясе, еще меньше – в рыбе. В овощах и фруктах железо содержится, но оно плохо усваивается. Обычно с помощью диеты покрыть дефицит железа можно при алиментарном его дефиците, а также если причиной было кровотечение, которое удалось радикально устранить.
Однако чаще для лечения ЖДА приходится назначать препараты железа. Лекарственные формы подразделяются на парентеральные и энтеральные. При легкой и средней тяжести анемии, а также при железодефицитном состоянии без анемии необходимо терапию начинать с препаратов для энтерального приема. При тяжелой степени анемии показано назначение препаратов железа для парентерального введения, а при угрожающем жизни состоянии могут быть назначены трансфузии эритроцитной взвеси.
-
1. Энтеральные препараты железа . Наиболее распространенной формой являются препараты двухвалентного железа, имеющие большую биодоступность (до 30-40%) по сравнению с трехвалентными (до 10%). Препараты двухвалентного железа представлены неорганическими (сульфаты, хлориды) и органическими (фумарат, глюконат) солями. Их можно подразделить на три группы [12].
I-я группа представлена сульфатами и прочими неорганическими соединениями металлов (соли и оксиды железа, меди, марганца и др.). В эту группу входят: Актиферрин (состоит из железа сульфата /34,5 мг Fe2+/ и D-, L-серин), Гемофер (железа хлорид /44 мг Fe2+), Гемофер пролонгатум (железа сульфат /105 мг Fe2+), Сорбифер Дурулес (железа сульфат /100 мг Fe2+ с аскорбиновой кислотой 60 мг), Тарди-ферон (железа сульфат /80 мг Fe2+ с аскорбиновой кислотой), Фенюльс (железа сульфат /50 мг Fe2+ с аскорбиновой кислотой 50 мг, тиамином монотартратом 2 мг, рибофлавином 2 мг, никотинамидом 2 мг, пиридоксином гидрохлорид 1 мг и пантотеновой кислотой 2,5 мг), Ферро-Фольгамма (железа сульфат /37 мг Fe2+, с фолиевой кислотой 5 мг и цианокобаламином 10 м), Ферроплекс (железа сульфат гепта- гидрат /50 мг Fe2+ с аскорбиновой кислотой 30 мг) и другие.
II-я группа – органическими солями, к которым относятся железа глюконат и железа фумарат, например, Ферронат (железа фумарат /20 мг Fe2+ в 1 мл суспензии/), Хеферол (железа фумарат /115 мг Fe2+/).
III-я группа – органическими формами железа в сочетании с синергидными компонентами, например, Тотема (железа глюконат дигидрата /50 мг Fe2+/ с марганцем 1,33 мг и медью 0,7 мг – в 1 мл или ампуле для приема внутрь), Ферретаб (железа фумарат /50 мг Fe2+/ в комбинации с фолиевой кислотой 0,5 мг).
Препараты трехвалентного железа представлены:
-
1) неорганическими солями – гидроксид в комплексе с полимальтозой, например, Феррум Лек (железа (III) гидроксид полимальтозат /100 мг Fe3+/), Мальтофер (железа (III) гидроксид полимальтозат /100 мг Fe3+/);
-
2) органическими солями – например, Ферлатум (железа протеин сукцинилат /40 мг Fe3+).
-
2 . Парентеральные препараты железа . При отсутствии эффекта на терапию препаратами железа для энтерального применения необходимо перейти на парентеральное введение. Эта группа препаратов представлена трехвалентным железом в различных комплексных соединениях. Применяется внутримышечно или внутривенно, в зависимости от препарата. Для внутримышечного введения применяются препараты Феррум Лек (железа (III) гидроксид по-лимальтозат / 50 мг Fe3+ в 1 мл/), Фербитол (желе-зосорбитоловый комплекс, форма выпуска по 2 мл в ампуле, что составляет 100 мг Fe3+). Их применение для лечения ЖДА в настоящее время оспаривается в связи с многочисленными осложнениями, включая образование стерильных абсцессов в области инъекций, гематом, длительного окрашивания кожи, кровотечения, некроз тканей или атрофия, боль. Из-за частых локальных осложнений терапия внутримышечным железом применяется в основном пациентам, у которых лечение препаратами железа внутрь оказалось не эффективным, а для внутривенного введения нет возможности. В любом случае, для парентерального препарата вводимую дозу железа необходимо рассчитывать по формуле Ган-зони, чтобы обеспечить полноценный эффект и не вызвать перегрузки организма железом:
Особенностью всасывания трехвалентного железа является то, что оно должно из трех валентного восстановиться до двухвалентного с помощью фермента ферроредуктазы и лишь потом с помощью двухвалентного металлотранспортера ДМТ1 транспортируется в клетку, как показано на рисунке 1. Хотя биодоступность препаратов трехвалентного железа при пероральном приеме ниже, тем не менее рандомизированные исследования показали, что эффективность пероральных препаратов двухвалентного и трехвалентного железа практически одинакова [1].
Однако существует и иной путь всасывания железа не непосредственно в кровоток, а через лимфатическую систему по всей поверхности тонкой кишки при участии иммунных М-клеток. Такой путь осуществляется благодаря сукросомальному железу, которое входит в такой препарат как Сидерал Форте, содержащий пирофосфат железа (III) в количестве 30 мг. Биодоступность такого железа в 2,7 раз выше, чем сульфата железа, но плохо регулируется (нет пути «выключения» всасывания), поэтому обычно терапия им не превышает более 30-45 дней. Учитывая иной механизм всасывания сукросомаль-ного железа оно эффективно не только для терапии ЖДА, но и при анемии хронического заболевания и при злокачественных новообразованиях, где присутствует гепсидиновый блок [10].
На всасывание двухвалентного железа могут оказывать продукты, с которыми принимается препарат, в частности, молочные (молоко, кефир, творог, сыр), так как они содержат кальций (двухвалентные ионы металла), который конкурирует за соединение с переносчиком двухвалентного металлотранспортера. Также ухудшают всасывание железа кофе, чай, прием антацидов, препараты, снижающие секрецию желудочного сока, в то время как на сукросомаль-ном железе (Сидерал Форте) негативный эффект продуктов не сказывается.
Проводя лечение препаратами железа важно оценить эффект. Положительный ответ на терапию считается, если у больного через 6–8 дней улучшается самочувствие, на 8–12-й день повышается число ретикулоцитов (ретикулоцитарный криз), а ежемесячная прибавка гемоглобина составляет 10 г/л и более.
Fe (мг) = М×(Hb целевой – Hb больного )×0,24 + 500 где:
-
- Fe (мг) – количество препарата, необходимое для лечения ЖДА;
-
- М – масса тела;
-
- Hb целевой – уровень целевого гемоглобина (150 г/л – для мужчин, 140 г/л – для женщин, 130 – для ребенка);
-
- Hb больного – имеющийся уровень гемоглобина у пациента;
-
- 0,24 – коэффициент, получают: 0,24 = 0,0034×0,07×1000 (где: 0,0034 – содержание железа в гемоглобине /0,34%/; 0,07 – объем крови 70 мл/кг массы тела /7% от массы тела/; 1000 – коэффициент пересчета /1 г = 1000 мг/);
-
- 500 – количество железа, необходимое для насыщения депо.
В педиатрической практике при массе тела ребенка менее 35 кг используется следующая расчетная формула:
Fe (мг) = М×(Hb целевой – Hb больного )×0,24 + 15×М где:
-
- 15×М – количество железа, необходимое для насыщения депо у ребенка с определенной массой тела;
-
- Hbцелевой – уровень целевого гемоглобина для ребенка равен 130 г/л.
Препараты для внутривенного лечения представлены трехвалентным железом и наиболее широкое распространение получили:
-
- железа (III) гидроксид сахарозный комплекс – Ликферр, Венофер и др. Для лечения оптимально вводить по 200 мг 3 раза в неделю. Максимально допустимая доза составляет 7 мг/кг (до 500 мг). Однако такую дозу препарата необходимо вводить медленно (в течение 3,5 часов) 1 раз в неделю. Эффект от лечения наступает быстро, часто назначают при почечной патологии, так как у данной категории пациентов нередко бывает гиперфосфатемия, которую и компенсирует данный препарат. Обычно первое введение требует проведения тест-дозы, чтобы избежать сосудистой реакции на железо, сопровождающаяся ознобом, изменением цвета кожных покровов до цианоза. При возникновении такой реакции введение препарата останавливают. После ее купирования можно продолжить дальнейшее введение препарата, так как чаще всего сосудистая реакция не повторяется, она чаще всего возникает вследствие быстрого введения раствора. Вот с какой целью проводят такую тест-дозу, позволяющую выявить подобную реакцию. При возникновении аллергической реакции любого типа введение данного препарата прекращают;
-
- железа (III) карбоксимальтозат – Феринжект обычно используют дозы от 200 мг до 1000 мг внутривенно, при этом 200 мг вводят внутривенно струйно медленно, предварительно разведя физиологическим раствором, а дозу 500 мг и более внутривенно капельно в течение 15 мин не чаще 1 раза в неделю, в виду риска развития гипофосфатемии;
-
- железа (III) гидроксид олигоизомальтозат – Монофер (дозы от 200 мг до 2500 мг на одно введение). Рассчитываемая максимальная инфузия составляет 20 мг/кг которую можно вводить в виде внутривенной инфузии в 500 мл физиологического раствора в течение 30 мин. Данный препарат можно использо-
- вать в таких высоких дозах благодаря тому, что матричная структура его включает стабильное и прочносвязанное железо, что позволяет осуществлять медленное контролируемое высвобождение биоактивного железа, которое связывается с белками-переносчиками железа и не вызывает токсического эффекта. Введение препарата не требует тест-дозы, имеет низкий риск анафилактических реакций и позволяет за одну инфузию обеспечить восполнение дефицита микроэлемента. Кроме того, гидроксид олигоизомальтозат трехвалентного железа имеет минимальный риск развития гипофосфатемии [15], которая сопровождается 6Н-синдромом (H – hyper-et hypo-), обусловленным биохимическим каскадом событий, вызванных препаратами железа:
-
1) гипер FGF23 – высокий уровень фактор роста фибробластов 23;
-
2) гиперфосфатурия;
-
3) гипофосфатемия;
-
4) гиповитаминоз D;
-
5) гипокальциемия;
-
6) гиперпаратиреоз вторичный [16].
-
3. Трансфузии донорских эритроцитов . Трансфузии эритроцитов при ЖДА, как правило, не назначаются. Все же, если у больного тяжелое состояние с уровнем гемоглобина менее 40-50 г/л, отмечается выраженная тахикардия, одышка, циркуляторные расстройства, нарушение сознания, обусловленное анемическим синдромом, и имеет место риск для
Патогенез гипофосфатемии обусловлен тем, что после внутривенного введения железа через почки теряются фосфаты. Выведение фосфатов с мочой регулируется фосфатурическим гормоном, он же является фактором роста фибробластов-23 (FGF23). Высокая концентрация активного железа в крови вызывает резкое повышение FGF23, а тяжесть ги-пофосфатурии зависит: 1) от уровня FGF23; 2) от скорости клубочковой фильтрации (при хронической почечной недостаточности – меньше). FGF23 также блокирует активацию витамина D, приводя к гипокальциемии и повышению паратиреоидного гормона (ПТГ). Фосфатуретическое действие ПТГ продлевает гипофосфатемию даже после нормализации уровня FGF23. Этот каскад эффектов назван 6H-синдромом. Специфические свойства железоуглеводного комплекса (сахарат оксида железа, сахарозный комплекс железа и полимальтозный комплекс железа) обусловлены появлением высокой концентрации железа, поэтому они могут вызывать гипофосфатемию с проявлением в виде 6 Н-синдрома, характеризующегося астенией, усталостью, миопатией, дыхательной недостаточностью, остеомаляцией с болями в костях, вплоть до переломов, что требует дополнительного лечения. Однако гидроксид олигоизомальтозат железа таким побочным эффектом не обладает, благодаря медленному высвобождению активного железа из его молекулы [15].
жизни, то могут быть назначены переливания донорских эритроцитов в количестве 1-2 дозы с последующим переходом на терапию препаратами железа. Также могут быть назначены переливания одногруппных эритроцитов при непереносимости препаратов парентерального железа, если имеется угроза прогрессирования и декомпенсации состояния на фоне тяжелой анемии.
Профилактика железодефицитной анемии
Основным методом профилактики железодефи-цита – адекватное, сбалансированное питание. Ежедневно с пищей поступает в организм 5–20 мг железа, но всасывается лишь 0,5–2 мг (около 5–10%). Но большинству лиц поступившее с пищей железо достаточно, для покрытия его потерь. Однако детям, находящимся на грудном и смешанном вскармливании, с четырех месяцев часто требуется дополнительное назначение препаратов железа по 1 мг в виде капель сиропа из расчета на 1 кг массы тела в сутки. Также недоношенным детям с первого месяца жизни рекомендуется прием препарата по 2 мг железа на 1 кг массы тела. Такую профилактику проводят до введения прикорма. Кроме того лицам, у которых имеет место хроническая кровопотеря при меноррагии или метроррагиях, при патологии пищеварительного тракта с нарушением всасывания (гастродуоденит, мальабсорбция, целиакия), при рецидивирующих микро- и/или макрокровотечениями (неспецифический язвенный колит, болезнь Крона, грыжа пищеводного отверстия диафрагмы), при ХПН у больных, получающих гемодиализ (теряется 40–50 мл крови за каждую процедуру), при злокачественных новообразованиях, сопровождающихся повторными кровотечениями, при частых донациях крови (у доноров), а также лицам, находящимся на вегетарианской диете, требуется назначение препаратов железа.
Профилактические меры подразумевают также проведение скрининговых исследований при обращении пациента за медицинской помощью к врачу, во время проведения медосмотра, диспансеризации. Необходимо обращать внимание на такие лабораторные маркеры дефицита железа как гемоглобин, гематокрит, MCV, MCH в гемограмме, а также сывороточное железо, ОЖСС, сывороточный ферритин, насыщение трансферрина железом, позволяющих выявить дефицит железа. Так, у детей в возрасте 2-5 лет, без факторов риска, обследование на предмет диагностики железодефицитной анемии проводится ежегодно; у детей школьного возраста и подросткам мужского пола скрининг на предмет выявления ЖДА осуществляют, если в анамнезе у них была ЖДА. Также скрининг на ЖДА проводится каждые 5–10 лет с подросткового возраста и весь детородный период у небеременных женщин; но у женщин с факторами риска развития ЖДА (обильная кровопотеря при менструации, фибромиоме, эндометрио- зе, недостаточном потреблении железа с пищей, при ЖДА в анамнезе) обследования проводят один раз в год. Диспансерное наблюдение за детьми и подростками, имеющих железодефицитную анемию, необходимо проводить в течение одного года с момента установления диагноза, оценивая самочувствие, общее состояние, а перед снятием пациента с диспансерного наблюдения выполняется клинический анализ крови, все показатели которого должны быть в пределах нормы [1].
Заключение
Таким образом, железодефицитная анемия является полиэтиологичным, наиболее часто встречающимся заболеванием, в основе которого лежит недостаток поступления, повышенная потеря или нарушенный баланс поступления и расход железа. Большую роль в диагностике и лечении ЖДА игра- ют врачи различных специальностей, так как зачастую лишь они могут установить причину дефицита железа и его устранить.
Тем не менее, даже устранив причину железоде-фицита, в большинстве случаев требуется дополнительная коррекция возникшей анемии. Поэтому в лекции изложена подробная информация по патогенезу, диагностике, клинической картине ЖДА, дана ее современная классификация, а также в полной мере представлены методы коррекции анемии, с акцентом на расчет дозы внутривенного препарата, а также приведено описание возможных нежелательных явлений на введение парентерального железа. Настоящая лекция будет полезна практическим врачам различных специальностей, клиническим ординаторам и студентам медицинских вузов.
Список литературы Железодефицитная анемиия (обзор литературы)
- Клинические рекомендации – Железодефицитная анемия – 2021 – 2022-2023 (09.09.2021) – Утверждены Минздравом РФ // [Электронный ресурс], последнее обращение 22.12.2023, http://gbpokachi.ru/upload/medialibrary/81b/hmct9ew0cod31zwgy2y2skydhvgcn4gk.pdf.
- Анемии. Краткое руководство для практических врачей всех специальностей под ред. О.А. Рукавицына 2-е издание, переработанное и дополненное. – Москва: ГЭОТАР-Медиа, 2021. – 352 с.
- Романенко Н.А., Грицаев С.В., Бессмельцев С.С. Анемия при онкогематологических и онкологических заболеваниях: патогенез, классификация, клиника, терапия: учебное пособие// Москва: ООО «Полиса медиа групп», 2021 – 112 с. (ISBN 978-5-6047276-0-7).
- Рациональная фармакотерапия в гематологии / под ред. профессора О.А. Рукавицына. – Москва: Литера, 2021. – 784 с.
- Цветаева Н.В., Левина А.А., Мамукова Ю.И. Основы регуляции обмена железа// Клиническая онкогематология. – 2010. – Т. 3, №3. – С. 278–283.
- Fischer-Fodor E., Miklasova N., Berindan-Neagoe I., Caha B. Iron, inflammation and invasion of cancer cells // Clujul Med.- 2015. – Vol. 88. – P. 272-277. DOI: 10.15386/cjmed-492.
- Тихомиров А.Л., Сарсания С.И., Ночевкин Е.В. Некоторые аспекты диагностики и лечения ЖДС в практической деятельности на современном этапе // Трудный пациент, 2011. – №11, Т.9. – С. 26-38.
- Романенко Н.А., Шилова Е.Р. Цитопенический синдром при депрессиях кроветворения. – Учебное пособие. – СПб.: Типография «Амиго-Принт», 2023. – 72 с. – (Непрерывное образование) ISBN 978-5-604981443.
- Haemoglobin concentrations for the diagnosis of anaemia and assessment of severity// WHO/NMH/NHD/MNM/2011. [Электронный ресурс], последнее обращение 12.12.2023, https://apps.who.int/iris/bitstream/handle/10665/85839/WHO_NMH_NHD_MNM_11.1_eng.pdf
- Gómez-Ramírez S., Brilli E., Tarantino G., Muñoz M. Sucrosomial® Iron: A New Generation Iron for Improving Oral Supplementation. Pharmaceuticals (Basel). – 2018. – Vol. 11, N4. – p. 97. doi: 10.3390/ph11040097.
- Романенко Н.А., Грицаев С.В., Шилова Е.Р., Солдатенков В.Е., Кайтанджан Е.И. Гемолитические анемии: учебное пособие / Н.А. Романенко, С.В. Грицаев, Е.Р. Шилова, В.Е. Солдатенков, Е.И. Кайтанджан. – СПб.: ООО «РПК «Амиго-Принт», 2023. – 164 с. – (Непрерывное образование). ISBN 978-5-6049814-0-5.
- Громова О.А., Торшин И. Ю. Микронутриенты и репродуктивное здоровье Руководство // М: «ГЕОТАР-Медиа», 2019. – 672 с.
- Минушкин О.Н., Елизаветина Г.А., Иванова О.И., Баркалова Ю.С. Новые технологии в лечении железодефицитной анемии. Мед. совет. – 2016. – Т. 14. – С. 116–121.
- Учебник по гематологии / Н.И. Стуклов, Г.И. Козинец, Н.Г. Тюрина. — М.: Практическая медицина, 2018. — 336 с.
- Wolf M., Rubin J., Achebe M. et al. Effects of Iron Isomaltoside vs Ferric Carboxymaltose on Hypophosphatemia in Iron-Deficiency Anemia: Two Randomized Clinical Trials // JAMA. – 2020. – Vol. 323(5). – P. 432–443 DOI: 10.1001/jama.2019.22450
- Schaefer B., Meindl E., Wagner S. et al. Intravenous iron supplementation therapy // 2020 Oct;75:100862. DOI: DOI: 10.1016/j.mam.2020.100862 [Электронный ресурс], последнее обращение 26.12.2023, https://pubmed.ncbi.nlm.nih.gov/32444112/


