Биотестирование целлюлозолитических бактерий как оценка безопасности в отношении простейших рубца жвачных
Автор: Воеводина Ю.А., Новикова Т.В., Рыжакина Т.П.
Журнал: Молочнохозяйственный вестник @vestnik-molochnoe
Рубрика: Сельскохозяйственные и ветеринарные науки
Статья в выпуске: 1 (57), 2025 года.
Бесплатный доступ
В статье представлены результаты исследования воздействия на организм жвачных животных простейших микроорганизмов с целлюлозолитической активностью и синтезируемых ими биологически активных веществ. В экспериментах использовали микроорганизмы, выделенные из рубца различных видов жвачных животных: крупного рогатого скота, мелкого рогатого скота и зубров. Токсикологическую оценку культуральной суспензии и супернатанта микроорганизмов выполняли экспресс-методом на культуре простейших рода брюхоресничных инфузорий Stylonychia mytilus. Показано, что исследуемые штаммы при экспонировании с инфузориями Stylonychia mytilus не оказывают на них негативного (угнетающего) воздействия.
Рубцовое пищеварение, простейшие рубца, целлюлозолитические микроорганизмы, степень усваивания питательных веществ
Короткий адрес: https://sciup.org/149148741
IDR: 149148741 | УДК: 636.085.25 | DOI: 10.52231/2225-4269_2025_1_39
Текст научной статьи Биотестирование целлюлозолитических бактерий как оценка безопасности в отношении простейших рубца жвачных
Повышение продуктивности животноводства достигается преимущественно благодаря интенсификации производства, укреплению кормовой базы и обеспечению сбалансированного питания сельскохозяйственных животных, включая внедрение современных методов получения кормов. В связи с этим разработка новых составов кормовых добавок и премиксов с микробиологическим компонентом становится значимой задачей, что подтверждается высоким спросом на такие продукты. Большое внимание уделяется изучению целлюлозолитических микроорганизмов и эффективности их использования в кормлении жвачных животных [1].
У жвачных животных уникальная система пищеварения: благодаря микроорганизмам-симбионтам они могут потреблять большое количество растительного корма. Сущность рубцового симбиоза – обеспечение переваривания за счет деятельности энзиматических систем микроорганизмов трудно расщепляемых компонентов корма, например клетчатки, что обеспечивает животное питательными веществами, летучими жирными кислотами (ЛЖК) и микробным белком.
Сообщество микроорганизмов рубца крупного рогатого скота включает также огромное количество разнообразных видов простейших [2, 3, 4]. Среди которых особое значение имеют инфузории, играющие ключевую роль в процессе разложения питательных компонентов кормов.
В этом контексте изучение влияния на них целлюлозолитических микроорганизмов, рассматриваемых как перспективные для разработки кормовых добавок, и продуцируемых ими биологически активных соединений, является актуальным.
Биотестирование на инфузориях компонентов кормовых добавок позволяет прогнозировать совокупное воздействие изучаемого фактора, в нашем случае микроорганизмов, так как реакция простейших зависит не только от наличия токсичных компонентов, но и от взаимодействия между собой биологических единиц. Биотестирование - это оценка свойств изучаемого объекта по его воздействию на биологическую тест-систему (далее – тест-систему) в стандартных условиях. Тест-система – это пространственно ограниченная совокупность чувствительных биологических элементов и среды, в которой они находятся [5].
Внастоящеевремя биотестированиеявляетсяоднимизнаправлений совершенствования системы оценок и контроля качества объектов окружающей среды. Не заменяя количественный химический анализ, биотестирование предваряет и дополняет его благодаря экспрессности, простоте исполнения и невысокой стоимости анализа [6].
Биоиндикация – это оценка качества среды обитания и ее отдельных характеристик по некоторому индикаторному показателю биоты в природных условиях. В качестве биоиндикаторов выступают отдельные таксоны, экологические группировки (например, в водной среде – фитопланктон, зоопланктон, бентос, перифитон), физиологически сходные организмы (например, имеющие одинаковый типпитания), размерныегруппы. Отклонениеиндикаторнойбиотической характеристики от некоторой заданной нормы свидетельствует о превышении уровней допустимого воздействия абиотических факторов. Биондикация – это метод обнаружения и оценки воздействия абиотических и биотических факторов на живые организмы при помощи биологических систем [7, 8].
Биотестирование позволяет оценить опасность воздействия химического загрязнения с помощью живых организмов не по отдельным химическим компонентам, а в целом по смесям, в том числе неизвестной природы [9].
Микроорганизмы – наиболее быстро реагирующие на изменение окружающей среды биоиндикаторы. Их развитие и активность находятся в прямой связи с составом органических и неорганических веществ в среде, так как микроорганизмы способны разрушать соединения естественного и антропогенного происхождений. На этом основаны принципы биоиндикации с использованием микроорганизмов. Необходимо иметь сведения о составе, количестве и функциональной активности последних [7].
Целлюлозолитические бактерии играют ключевую роль в расщеплении клетчатки у жвачных животных. Они способствуют улучшению усвояемости корма, что напрямую влияет на продуктивность животных. Важно отметить, что при использовании этих бактерий при производстве кормовых добавок, увеличивающих конверсию корма, необходимо учитывать их взаимодействие с другими микробами в рубце, включая простейших и инфузорий [10, 11].
Биотестирование является важным инструментом для оценки безопасности и эффективности различных биологических объектов, включая целлюлозолитические бактерии, используемые в кормлении жвачных.
В контексте тестирования целлюлозолитических бактерий, важно выбрать подходящие тест-объекты, такие как инфузории и простейшие, которые могут служить индикаторами безопасности. Они используются для оценки остроты токсичности и реакции на загрязнители. В России в настоящее время биотестирование применяется для оценки токсичности вод водоохранными организациями различных ведомств. Установлены нормативы качества воды по данным биотестирования [12].
Инфузории, такие как лабораторная культура стилонихий
Stylonychia mytilus, являются одним из самых перспективных тест-объектов для биотестирования. Они обладают высокой чувствительностью к токсическим веществам и могут быть использованы для оценки остроты токсичности кормов. Методика оценки основана на сравнении численности инфузорий до и после введения исследуемой пробы, что позволяет быстро получить результаты о токсичности.
Для оценки безопасности штаммов целлюлозолитических бактерий в отношении инфузорий стилонихий проводят серию биотестов. Эти тесты включают некоторые показатели, например: оценку токсичности, которая показывает влияние микроорганизмов на жизнеспособность инфузорий при различных концентрациях бактерий; наблюдение за поведением, подразумевающее анализ изменений в поведении инфузорий при контакте с тестируемыми штаммами и др. [13].
Выбор конкретного тест-объекта Stylonychia mytilus зависит от наших целей исследования – выявить токсическое воздействие целлюлозолитических бактерий, выделенных из рубца жвачных. Эти данные необходимы в дальнейшем для производства кормовой добавки, одним из составляющих которой будут целлюлозолитические бактерии.
Материалы и методы
Работа проведена на кафедре эпизоотологии и микробиологии ФГБОУ ВО Вологодская ГМХА. Для проведения биологического тестирования было отобрано 12 штаммов микроорганизмов, обладающих целлюлозолитической активностью, выделенных от крупного и мелкого рогатого скота и зубров.
Культуры для исследования отбирали по комплексу тестов, характеризующих целлюлозолитическую активность изучаемых штаммов [14].
Для поддержания культур использовали субкультивирование (пересев каждые 3 недели) вглубь полужидкой среды Гетчинсона с КМЦ (до 1% КМЦ, ПЖ 0,7%, рН 7,2) (Гч-КМЦ). Посевы инкубировали при 37 °С в течение двух суток, а затем хранили при температуре бытового холодильника 4 °С.
Культивирование штаммов для проведения исследования проводили на жидкой среде Гетчинсона с КМЦ (до 1% КМЦ, рН 7,2) - Гч-КМЦ. Посевы инкубировали при 37 °С в течение трех суток [6, 7]. Опыт проводили с культуральной жидкостью и с супернатантом. Супернатант отделяли центрифугированием на лабораторной центрифуге СМ-50М при 15000 об/мин в течение 10 минут.
Дальнейшие исследования проводили с использованием методик, описанных в литературе [17, 18].
Для биотестирования использовали суточную культуру стилонихий, находящуюся в фазе экспоненциального (активного) ро- ста. Каждый образец исследовали пятикратно. Пересадку и подсчет стилонихий проводили под бинокулярной лупой «Микромед» МС-1 2С при увеличении 10 × 4 и 10 × 2.
В лунки планшета вносили по 20 мкл среды со стилонихиями, проводили подсчет их количества (в каждую лунку вносили не менее 10 инфузорий), травмированные клетки не учитывали, затем добавляли 20 мкл исследуемой пробы, спустя пять минут производили предварительный просмотр и подсчет количества живых инфузорий. Планшет с исследуемым материалом помещали в термостат и экспонировали в течение 3-х часов при температуре 21 °С. Затем подсчитывали количество живых инфузорий, определяли процент их гибели.
Выживаемость высчитывали по формуле:
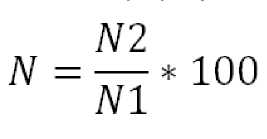
где N 2 - среднеарифметическое (из пяти испытаний) значение количества стилонихий в конце опыта через 3 ч экспозиции, шт.
N1 – среднеарифметическое (из пяти испытаний) значение количества стилонихий в начале опыта, шт.
100 – коэффициент перевода результата в проценты.
В опыте заведомо создавали плотные условия контакта инфузорий с испытуемыми штаммами культур, для большей наглядности и достоверности опыта.
Известно, что при возникновении неблагоприятных условий микроорганизмы способны индуцировать синтез белков (ферментов, токсинов, гормонов, антибиотиков), которые экспортируются из клетки во внешнюю среду и могут оказывать патологическое воздействие на простейших рубца [19, 20, 21].
Испытуемые образцы выдерживали при температуре +2–4 °С в течении 3 суток, полученный супернатант использовали для дальнейших исследований.
Результаты проведенных исследований статистически обработаны с применением программы MEDSTATISTIC. Рассчитывали средние арифметические и доверительные интервалы с уровнем вероятности 0,95, коэффициент вариации признака.
Результаты исследования
Подсчет количества стилонихий, оценку их состояния (рис. 1) проводили под бинокулярной лупой «Микромед» МС-1, при этом травмированные клетки стилонихий (неподвижные, округлой формы) не учитывали.

Рисунок 1 – Микроскопия и количественный подсчет стилонихий
Результаты исследований по оценке выживаемости инфузорий в опыте с культуральной жидкостью тестируемых штаммов предоставлены в таблице 1.
Таблица 1 – Процент выживаемости Stylonychia mytilus при экспозиции с культуральной жидкостью, %
|
№ образца |
Средняя арифметическая М + m |
Стандартное квадратичное отклонение (σ) |
Коэффициент вариации (Cv) |
|
Контроль |
93,39 + 4,59 |
9,19 |
9,84% |
|
Шз4 |
92,89 + 3,5 |
7,18 |
7,73% |
|
Шз5 |
94,10 + 2,69 |
5,39 |
5,73% |
|
Шз13 |
93,92 + 2,98 |
5,95 |
6,34% |
|
Шз21 |
89,94 + 6,08 |
12,17 |
13,53% |
|
Шз23 |
95,86 + 2,85 |
5,70 |
5,95% |
|
Шкрс11 |
90,64 + 3,31 |
6,62 |
7,30% |
|
Шкрс17 |
93,30 + 3,57 |
7,15 |
7,66% |
|
Шкрс14 |
90,63 + 0,66 |
1,32 |
1,46% |
|
Шкрс16 |
93,45 + 3,48 |
6,95 |
7,44% |
|
Шкрс19 |
96,04 + 1,82 |
3,64 |
3,79% |
|
Шмрс34 |
91,66 + 2,32 |
4,65 |
4,90% |
|
Шмрс35 |
94,90 + 1,45 |
2,89 |
3,05% |
|
Шз – штаммы, выделенные от зубра. Шкрс – штаммы, выделенные от крупного рогатого скота. Шмрс – штам мы, выделенные от мелкого рогатого ск ота. |
|||
Средняя арифметическая (М + m) указывает на среднее значение ряда данных и его доверительный интервал.
Стандартное квадратичное отклонение (σ) характеризует разброс данных относительно среднего: чем больше значение, тем больше разброс.
Коэффициент вариации (Cv) позволяет сравнивать степень вариабельности между различными выборками, независимо от их среднего значения.
Максимальный процент выживаемости инфузорий отмечен в контрольной пробе и опытной Шз5 пробе: 93,39% и 94,10% соответственно. Стандартное отклонение незначительное.
Самый низкий процент выживаемости отмечен при воздействии на инфузории Шз21 - 89,94%, стандартное квадратичное отклонение самое высокое среди исследуемых образцов – 12,17, но данное значение позволяет считать совокупность данных однородной.
Наименьший коэффициент вариации признака установлен у штамма Шкрс14: Cv = 1,46%. Это указывает на низкий уровень разброса относительно среднего значения, что говорит о большой однородности данных по образцу.
Наибольший коэффициент вариации исследуемого признака у штамма Шз21: Cv = 13,53%, средний уровень вариабельности признака, среднее значение в достаточной степени характеризует вариационный ряд.
Можно заметить, что группа образцов Шкрс демонстрирует в целом меньшую вариабельность, чем остальные группы. В частности, у образцов этой группы низкие коэффициенты вариации и стандартные отклонения. Группа образцов Шз характеризуется большими колебаниями значений, особенно у образца Шз21.
Таким образом, на основании анализа данных можно сказать, что наиболее стабильные и точные измерения были получены для образцов группы Шкрс, особенно для образцов Шкрс14 и Шкрс19. Наименее стабильны и точны измерения для образцов группы Шз, особенно для образца Шз21.
Статистически значимые отличия между штаммами, а также между контрольной и опытными группами не выявлены.
Из данных, представленных в таблице видно, что процент выживаемости инфузорий в опытных пробах не имел достоверных отличий с контролем, культуральная жидкость бактерий не оказывала на них токсического воздействия.
Результаты воздействия супернатанта трехсуточной культуры тестируемых штаммов микроорганизмов на выживаемость инфузорий в течение трех часов совместного экспонирования представлены в таблице 2.
Таблица 2 – Процент выживаемости Stylonychia mytilus при экспозиции с супернатантом, %
|
№ образца |
Средняя арифметическая М + m |
Стандартное квадратичное отклонение (σ) |
Коэффициент вариации (Cv) |
|
Контроль |
97,69 + 1,59 |
3,18 |
3,26% |
|
Шз4 |
92,16 + 3,79 |
7,58 |
8,22% |
|
Шз5 |
97,54 + 1,85 |
3,70 |
3,79% |
|
Шз13 |
97,03 + 2,04 |
4,07 |
4,20% |
|
Шз21 |
95,82 + 2,95 |
5,90 |
6,16% |
|
Шз23 |
96,38 + 1,75 |
3,49 |
3,63% |
|
Шкрс11 |
96,38 + 1,75 |
3,49 |
3,63% |
|
Шкрс17 |
95,34 + 3,84 |
7,68 |
8,06% |
|
Шкрс14 |
90,24 + 7,40 |
14,80 |
16,40% |
|
Шкрс16 |
95,12 + 3,70 |
7,40 |
7,78% |
|
Шкрс19 |
94,76 + 2,58 |
5,15 |
5,44% |
|
Шмрс34 |
96,38 + 2,16 |
4,32 |
4,48% |
|
Шмрс35 |
96,68 + 1,61 |
3,21 |
3,32% |
|
Шз- штаммы, выделенные от зубра. Шкрс – штаммы, выделенные от крупного рогатого скота. Шмрс – штаммы, выделенные от мелкого рогатого скота. |
|||
Максимальный процент выживаемости инфузорий отмечен в контрольном образце – 97,69% и при экспозиции со штаммом Шз5 – 97,54%, стандартное отклонение низкое, коэффициент вариабельности признака 3,26% и 3,79% соответственно, что говорит об однородности данных и их пригодности для анализа.
Минимальный процент выживаемости, среди исследуемых образцов, после экспозиции с супернатаном Шкрс14 - 90,24%, стандартное отклонение и коэффициент вариации средний 14,80 и 16,40% соответственно, что позволяет считать среднее значение в достаточной степени характеризующим вариационный ряд.
Анализ по группам образцов показывает, что группа штаммов Шз в целом демонстрирует средний уровень стандартных отклонений и коэффициентов вариации. Самый большой разброс данных наблюдается у образца Шз4 (σ = 7,58, Cv = 8,22%), самый маленький – у Шз5 (σ = 3,70, Cv = 3,79%).
Группа штаммов Шкрс: отмечаются значительные различия между образцами. Например, у Шкрс14 очень высокие показатели стандартного отклонения и коэффициента вариации (σ = 14,80, Cv = 16,40%), что говорит о неоднородности данных. Напротив, у Шкрс11 и Шкрс17 эти показатели ниже (о = 3,49, Cv = 3,63% и о = 7,68, Cv = 8,06% соответственно).
ГруппаШмрс: показатели стандартногоотклонения икоэффициента вариации находятся на среднем уровне. У Шмрс34 они составляют σ = 4,32, Cv = 4,48%, а у Шмрс35 — σ = 3,21, Cv = 3,32% (табл. 3).
Таблица 3 – Процент выживаемости Stylonychia mytilus при экспозиции с супернатантом после холодовой выдержки культур тестируемых штаммов, %
|
№ образца |
Средняя арифметическая М + m |
Стандартное квадратичное отклонение (σ) |
Коэффициент вариации (Cv): |
|
Контроль |
93,04 + 3,94 |
7,88 |
8,47% |
|
Шз4 |
86,71 + 3,80 |
7,59 |
8,76% |
|
Шз5 |
87,60 + 6,16 |
12,32 |
14,06% |
|
Шз13 |
88,64 + 4,54 |
9,08 |
10,25% |
|
Шз21 |
83,74 + 4,90 |
9,80 |
11,70% |
|
Шз23 |
83,84 + 7,53 |
15,05 |
17,95% |
|
Шкрс11 |
86,06 + 1,82 |
3,64 |
4,23% |
|
Шкрс17 |
86,78 + 6,97 |
13,93 |
16,06% |
|
Шкрс14 |
84,30 + 2,77 |
5,55 |
6,58% |
|
Шкрс16 |
80,94 + 3,69 |
7,38 |
9,12% |
|
Шкрс19 |
87,36 + 5,95 |
11,91 |
13,63% |
|
Шмрс34 |
85,56 + 8,78 |
17,57 |
20,53% |
|
Шмрс35 |
88,50 + 4,47 |
8,94 |
10,11% |
Контрольный образец показывает наибольшую выживаемость инфузорий – 93,04%; наименьшее стандартное квадратичное отклонение (7,88) и низкий коэффициент вариабельности признака, что делает его эталоном для сравнения с другими группами.
Выживаемость инфузорий в других образцах варьируется от 80,94% (Шкрс16) до 88,64% (Шз13).
Наибольший разброс данных относительно среднего значения наблюдается у образца Шмрс34 (σ = 17,57), что свидетельствует о значительной вариабельности результатов, коэффициент вариации 20,53% показывает неоднородность группы. Полученный результат не позволяет установить достоверную разность анализируемого показателя относительно контроля.
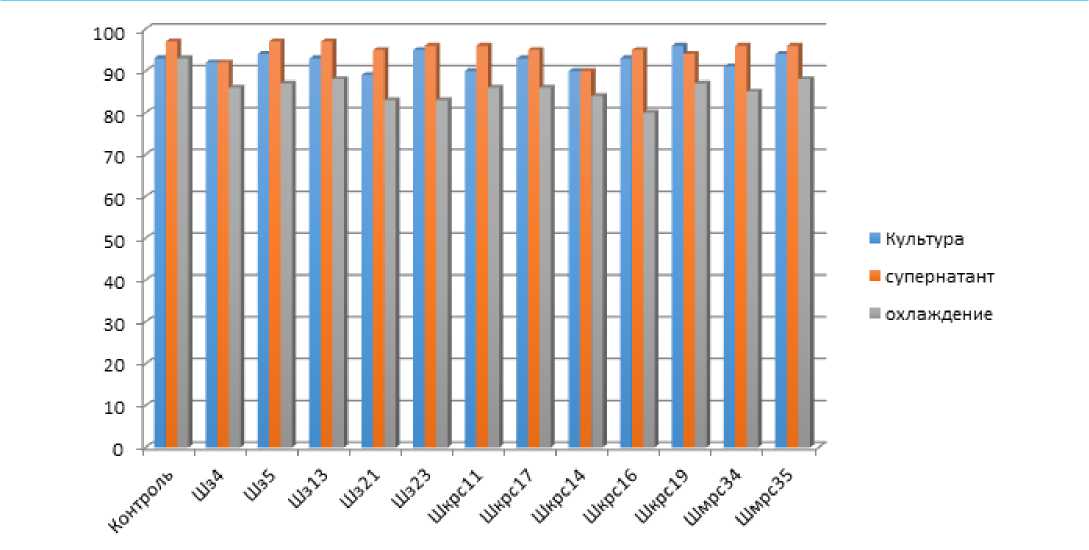
Рисунок 2 – Выживаемость инфузорий Stylonychia mytilus при экспозиции с культуральной жидкостью, супернатантом, и супернатантом после холодовой выдержки, %
Из данных, представленных в диаграмме (рис. 2), видно, что наименьшее воздействие на культуру инфузорий оказывает супернатант: выживаемость от 90,24% до 97,54%, что сопоставимо с контрольным образцом.
В опыте с культуральной жидкостью выживаемость инфузорий в контроле составила 93,39%, наименьший уровень выживаемости в опытных образцах – 89,94%, достоверных отличий между опытным и контрольным образцом не обнаружено. Согласно нормативной документации [9] исследуемые образцы не являются токсичными.
Оценка влияния супернатанта полученного после холодовой выдержки показала, что процент выживаемости инфузорий снижался во всех испытуемых образцах, но не был ниже 80%. Полученный результат говорит о способности испытуемых образцов выделять вещества, оказывающие негативное воздействие на простейших, но это количество незначительно и не приводит к изменению оценки токсичности образца [9].
Обсуждение
Коэффициент вариации (CV) показывает степень изменчивости по отношению к среднему показателю выборки. В статистике принято, что если коэффициент вариации меньше 10%, то степень рассеивания данных считается незначительной; если от 10 до 20% – средней; больше 20% и меньше или равно 33% – значительной. Уровень вариабельности исследуемого признака почти у всех изучаемых образцов до 20% – средний уровень изменчивости.
Вариабельность исследуемого признака в 12 образцах из 13 была в пределах 10%, степень рассеивания незначительная. Совокупности однородны по своему составу и средние представительны, данные являются достоверными и могут быть использованы для проведения анализа.
Среднеквадратическое отклонение, показатель рассеивания значений случайной величины относительно её математического ожидания, показывает низкий разброс значений в представленном множестве со средней величиной множества, то есть значения множеств сгруппированы вокруг среднего значения. Полученные результаты показывают, что данные являются значимыми и статистически достоверными.
При расчете значения t-критерия Стьюдента при уровне значимости р = 0,05 достоверно значимая разница между контролем и опытными образцами не выявлена. Из этого следует, что испытуемые штаммы микроорганизмов не оказывали негативного воздействия на основную тест-культуру инфузорий Stylonychia mytilus.
Выводы
В результате изучения научной литературы мы пришли к выводу, что целлюлозолитические микроорганизмы являются самыми важными в процессе пищеварения жвачных животных. Необходимо помнить, что микробиологические компоненты при искусственном введении в состав корма не должны неблагоприятно воздействовать на почвенный микробиом.
Материалом для исследования послужили штаммы микробиома рубца, выделенные от крупного и мелкого рогатого скота и зубров.
В результате проведенных исследований можно сделать следующие выводы.
Культуральная жидкость целлюлозолитических бактерий, выделенных из рубца зубров, крупного и мелкого рогатого скота, на выживаемость инфузорий достоверно негативного влияния не оказала.
Наименьшее воздействие на культуру инфузорий оказывает супернатант.
-
3. При оценке влияния супернатанта, полученного после холодовой выдержки, выявили, что процент выживаемости инфузорий снижался во всех испытуемых образцах, но не был ниже 80%.
Таким образом, результат проведенных исследований говорит о способности испытуемых образцов выделять вещества, оказывающие негативное воздействие на простейших, но это количество незначительно и не приводит к изменению оценки токсичности образца, что в дальнейшем дает возможность рекомендовать использование целлюлозолитические бактерии при производстве кормовых добавок.


