Цитологическая оценка динамики репаративных процессов в ранах у кроликов при использовании классического метода лечения мазью «Левомеколь»
Автор: Чуев Н.А.
Журнал: Молочнохозяйственный вестник @vestnik-molochnoe
Рубрика: Сельскохозяйственные и ветеринарные науки
Статья в выпуске: 3 (59), 2025 года.
Бесплатный доступ
В данной работе представлена цитологическая и бактериологическая оценка динамики заживления ран у кроликов при применении классического метода лечения мазью «Левомеколь». Метод мазков-отпечатков использовался для анализа клеточного состава и микрофлоры раневого экссудата на протяжении 10 суток эксперимента. Наблюдалось закономерное снижение нейтрофильной инфильтрации, появление макрофагов и фибробластов, уменьшение числа бактерий, а также снижение индекса бациллярной активности. Результаты демонстрируют эффективность мази «Левомеколь» в купировании воспаления и активации процессов репарации. Полученные цитограммы позволяют объективно отслеживать стадии раневого процесса и использовать мазки-отпечатки как информативный метод контроля лечения.
Рана, мазь «Левомеколь», цитограмма, мазок-отпечаток, бактериальная флора, воспаление, заживление
Короткий адрес: https://sciup.org/149149261
IDR: 149149261 | УДК: 619.6:616.5-002.3:615.46 | DOI: 10.52231/2225-4269_2025_3_67
Текст научной статьи Цитологическая оценка динамики репаративных процессов в ранах у кроликов при использовании классического метода лечения мазью «Левомеколь»
Актуальность
Проблема заживления кожных ран у лабораторных животных остаётся одной из ключевых задач экспериментальной и клинической ветеринарии. Повреждение кожного покрова сопровождается сложным каскадом клеточных и молекулярных событий, включающих воспаление, пролиферацию, ремоделирование ткани и контроль микробной контаминации. По данным A. Grada и соавторов, кролики являются надёжной моделью для изучения процессов репарации и эффективности новых терапевтических подходов [10].
Широкое распространение получили подходы с применением ло- кальных средств, способствующих стимуляции грануляции, антимикробной защите и ускорению эпителизации. B.G. Campbell указывает на эффективность мазевых препаратов при лечении инфицированных ран у кроликов [1]. Особенно важны средства, обладающие как про-тивомикробным, так и репаративным действием. В этом контексте мазь «Левомеколь», содержащая хлорамфеникол и метилурацил, используется как стандарт лечения и служит надёжной точкой сравнения в экспериментальных моделях.
Ряд авторов подчеркивает значимость цитологического контроля для оценки фаз воспаления, клеточного состава и динамики репарации [2, 9]. Цитограмма позволяет оперативно оценить доминирующий тип клеток – нейтрофилов, макрофагов, лимфоцитов или фибробластов – и тем самым судить о фазе воспаления или регенерации.
Дополнительную значимость приобретают методы морфометрического и бактериологического контроля. W. Zhang и соавторы показали, что бактериальная обсеменённость оказывает прямое влияние на скорость эпителизации и переход в фазу восстановления [4]. Использование цитологических мазков-отпечатков позволяет визуально оценивать степень микробной инвазии и уровень воспалительной инфильтрации, что особенно ценно в динамических наблюдениях [11, 12].
Также внимание исследователей привлекает эффективность средств на основе хитозана и плазменных продуктов, способствующих стимуляции ангиогенеза и формированию новой ткани [3, 6, 7, 8]. Эти работы подтверждают активное развитие направления локального патогенетического воздействия при раневой патологии.
Таким образом, анализ литературы свидетельствует о высокой актуальности цитологического подхода в исследовании динамики заживления ран и о целесообразности изучения классических схем терапии с использованием мази «Левомеколь» [5].
Цели и задачи
Целью настоящей работы является комплексная цитологическая и бактериологическая оценка динамики заживления поверхностных ран у кроликов при применении традиционного метода лечения с использованием мази «Левомеколь» для определения эффективности данного подхода на основе анализа клеточного состава мазков-отпечатков, бактериальной культуры и уровня бациллярной активности.
Для достижения поставленной цели были сформулированы следующие задачи исследования:
-
• провести цитологический анализ мазков-отпечатков с ран у кроликов в различные сроки лечения (на 1, 3, 5, 7 и 10 сутки) с определением морфологических типов клеток (нейтрофилы, макрофаги, лимфоциты, фибробласты, элементы эпителия), с учётом их зрелости, количества и динамики в ходе заживления;
-
• оценить динамику цитограммы - количественное и качественное изменение воспалительных и репаративных клеток, а также степень полиморфно-ядерной инфильтрации на различных этапах регенерации;
-
• провести бактериологическое исследование микрофлоры раневой поверхности, выявляя степень контаминации мазков и изменение плотности бактериальной нагрузки в динамике лечения;
-
• оценить уровень бациллярной активности (БАИ) с использованием метода на основе 5-балльной шкалы, отслеживая антибактериальный эффект терапии;
-
• определить морфологические признаки и родовую принадлежность микрофлоры, используя световую микроскопию, морфотипи-рование и особенности окрашивания по Романовскому – Гимзе;
-
• сравнить полученные результаты с данными литературных источников, оценив эффективность традиционного лечения мазью «Левомеколь» в контексте современных представлений о ранозаживляющей терапии в ветеринарной медицине.
Материалы и методы
Исследование проводилось на пяти клинически здоровых беспородных кроликах в возрасте 1 года, массой 2,0-2,5 кг. Животные содержались в стандартных условиях, с рационом, включающим комбикорм «ПК-90» и сено «разнотравье». Все манипуляции проводились в соответствии с ветеринарно-санитарными нормами. Поверхностную рану площадью 5x5 см формировали между лопатками под местной инфильтрационной анестезией. Работа была выполнена на базе кафедры анатомии, патологической анатомии и хирургии, а также зоофермы Института прикладной биотехнологии и ветеринарной медицины ФГБОУ ВО «Красноярский государственный аграрный университет».
Кролики составляли контрольную группу (n = 5), где ежедневно применялась мазь «Левомеколь» на раневую поверхность на протяжении 17 суток. Контрольные точки исследования – 3, 5, 7, 10, 12, 15 и 17 сутки. Такой протокол позволяет отследить ключевые фазы воспаления, пролиферации и репарации, как это описано в работах Hussien D. и Gentzkow B., Bayat M. [3, 5].
Методика забора материала
Цитологический материал получали методом мазка-отпечатка: стерильное предметное стекло прикладывалось к раневой поверхности, затем фиксировалось метанолом и окрашивалось по Романовскому - Гимзе. Метод рекомендован для динамического неинвазивного контроля за клеточным составом в области повреждения [9]. Выбор метода мазков-отпечатков обоснован его малой инвазивностью, возможностью многократного проведения динамического наблюдения без нанесения дополнительных повреждений тканям, а также высокой воспроизводи- мостью и доступностью в условиях лабораторной ветеринарной практики [4].
Метод цитологического исследования
Для оценки репаративных процессов и воспалительной реакции применяли метод цитологического исследования. Изучение клеточного состава мазков-отпечатков проводилось с использованием световой микроскопии (увеличение ×400, ×1000). В ходе анализа идентифицировались морфологические типы клеток: нейтрофильные гранулоциты, макрофаги, лимфоциты, клетки базального и плоского эпителия, а также элементы крови (эритроциты и тромбоциты). Данный метод позволяет с высокой чувствительностью и информативностью оценить клеточную реакцию в очаге поражения, отследить динамику воспалительного процесса, а также характер пролиферации и регенерации тканей. Именно эти параметры являются критически важными для выявления репаративного потенциала применяемой терапии, в том числе характера смены воспалительного инфильтрата на клетки грануляционной ткани. Основное внимание уделялось динамике цитограммы: смене воспалительных клеток на элементы репаративного плана (макрофаги, фибробласты), а также степени полиморфно-ядерной инфильтрации. [2]. Изучались качественные и количественные характеристики клеточного состава: доля нейтрофилов, макрофагов, лимфоцитов, эпителиоцитов, фибробластов и их зрелость. Также фиксировалось наличие и морфотип бактериальной флоры. Анализ морфотипов и их долевого соотношения позволял судить о фазах воспаления и репарации [2, 6]. Особое внимание уделялось смене полиморфно-ядерной инфильтрации на клетки грануляционной ткани как критерию эффективности проводимой терапии.
Метод оценки бациллярной активности
Для количественной и объективной оценки степени бактериальной обсемененности ран и мониторинга эффективности антимикробной терапии в динамике нами был использован метод оценки по индексу бациллярной активности. Индекс БАИ – это шкала оценки степени микробной нагрузки в мазках-отпечатках, основанная на визуальной градации количества грамотрицательной и грамположительной микрофлоры при микроскопии, что позволяет выявить интенсивность бактериальной контаминации в балльной форме. Метод имеет шкалу от 0 до 5 баллов, где:
-
• 5 баллов – сплошные скопления грамотрицательной флоры;
-
• 4 балла – обильная бациллярная контаминация;
-
• 3 балла – умеренное количество палочек/кокков;
-
• 2 балла – единичные бактерии;
-
• 1 балл – минимальная микрофлора;
-
• 0 баллов – бактерии не определяются.
Данный метод обеспечивает объективную количественную оценку выраженности бактериальной обсемененности раневой поверхности без необходимости проведения сложного бактериологического посева, а также позволяет сопоставлять результаты между временными точками исследования, что соответствует методическим подходам, описанным W. Zhang и соавторов [4] и B.G. Campbell [1]. Он особенно эффективен при наблюдении за динамикой процессов санации и регенерации, так как быстро и наглядно отражает изменение микробной нагрузки под влиянием терапии.
Метод определения родовой принадлежности микрофлоры
В рамках цитологического исследования мазков-отпечатков из ран проводилась морфологическая идентификация бактерий с целью определения их предположительной родовой принадлежности. В поле зрения регистрировались бактерии, оценивались их форма, размеры, окраска и расположение.
Использовалась морфологическая классификация, основанная на:
-
• форме бактерий: кокки (шарообразные), бациллы (палочки), вибрионы (изогнутые палочки), спиральные формы;
-
• характере расположения: парные (диплококки), цепочки (стрептококки), скопления (стафилококки);
-
• особенностях окрашивания: цвет цитоплазмы и ядра после окраски по Романовскому – Гимзе (что позволяет ориентироваться на грам-статус бактерий – грамположительные обычно окрашиваются в синие или фиолетовые тона, грамотрицательные – в розово-красные);
-
• размере клеток - визуально оценивался диаметр и длина бактериальных форм, что позволяло исключать или предполагать определённые роды.
-
• Интерпретация результатов
-
• На основании морфотипа и окраски бактерий, производилась предварительная родовая атрибуция микроорганизмов, например:
-
• стафилококки - грамположительные кокки, образующие скопления;
-
• стрептококки - грамположительные кокки в цепочках;
-
• бациллы (Bacillus spp.) - грамположительные палочки, часто с эндоспорами;
-
• энтеробактерии - грамотрицательные палочки, равномерно окрашенные, разбросанные или в параллельных группировках.
Идентификация носила ориентировочный характер, но была достаточной для динамического анализа микрофлоры в процессе лечения. Выбор метода обусловлен необходимостью оценки динамики микрофлоры в режиме реального времени, без необходимости культивирования, что особенно ценно для серийных наблюдений у подопытных животных.
Методика расчёта площади бактериальной колонизации
Для количественной оценки степени бактериальной контаминации в мазках-отпечатках применялся метод бактериоскопического анализа, основанный на измерении площади микробной колонизации (в мм²) в фиксированном поле зрения микроскопа.
Этапы проведения расчёта
-
1. Подготовка и окрашивание мазков: мазки-отпечатки с поверхности ран у экспериментальных животных готовились стандартным способом и окрашивались по Романовскому – Гимзе для визуализации бактериальных тел.
-
2. Микроскопирование: анализ проводился при увеличении ×1000 в иммерсионной системе. Изучались не менее 10 полей зрения на каждый мазок, равномерно распределённых по площади препарата. Это позволяло избежать искажения результатов из-за локальной агрегации бактерий.
-
3. Фиксация и перевод изображения: с помощью цифровой камеры (приставка к микроскопу) фиксировались изображения полей зрения. Далее фотографии экспортировались в программное обеспечение для морфометрического анализа (ImageJ, ZEN).
-
4. Выделение контуров бактериальных скоплений: в программной среде производилась полуавтоматическая обводка зон бактериальных скоплений на изображении. При этом учитывались только скопления визуализированных микроорганизмов, без включения клеточных элементов.
-
5. Расчёт площади: программа автоматически определяла площадь выделенных зон с бактериальной флорой в каждом поле зрения, переводя её в абсолютные единицы (мм² или мкм²) с последующим переводом в сантиметры квадратные (см²) для единообразия.
-
6. Агрегация данных: средняя площадь бактериальной колонизации рассчитывалась по каждому животному в каждой контрольной точке (день 1, 3, 5, 7, 10) и вносилась в итоговую таблицу. Полученные значения использовались для построения графика динамики бактериальной нагрузки. Методика оценки площади бактериальной колонизации позволила объективно и количественно проследить снижение микробной нагрузки в динамике, под воздействием терапии. Это дополнило шкалу бациллярной активности и обеспечило высокую достоверность результатов.
Результаты
В ходе исследования были проанализированы цитологические и бактерископические изменения в мазках-отпечатках ран у кроликов контрольной группы, получавших лечение мазевой повязкой с препаратом Левомеколь. Мазки анализировались в динамике на 1-е, 3-е, 5-е, 7-е и 10-е сутки.
Цитологический анализ выявил отчетливую фазность репаративного процесса. На ранних сроках (1–3 сутки) в мазках преобладали нейтрофильные гранулоциты, свидетельствующие об остром воспалительном процессе. Часть нейтрофилов имела признаки дегенерации и вакуолизации, что отражало активный фагоцитоз в очаге повреждения. Наряду с этим наблюдались единичные лимфоциты и макрофаги. Базофильные клетки и элементы плоского эпителия практически отсутствовали.
К 5-м суткам цитограмма демонстрировала снижение доли нейтрофилов, наряду с ростом количества макрофагов и лимфоцитов. Начали появляться молодые фибробласты, что указывало на переход воспалительной реакции в фазу пролиферации. Также отмечено увеличение числа эпителиальных клеток, в том числе базального типа, отражающих восстановление покровных структур.
К 7-м и 10-м суткам цитологическая картина свидетельствовала о нормализации клеточного состава: на фоне снижения нейтрофильной инфильтрации преобладали макрофаги, лимфоциты и зрелые фибробласты. Уменьшилась деструкция клеток, что коррелировало с завершением фазы воспаления и развитием репарации. Бактериологический анализ мазков-отпечатков позволил определить морфотипы бактерий и их родовую принадлежность. Результаты оценки цитологических и бактериальных структур в мазках-отпечатках представлены в таблице 1.
Таблица 1 – Цитологическая и бактериометрическая характеристика мазков-отпечатков в динамике наблюдения
|
День наблюдения |
Бациллярная активность (баллы) |
Преобладающие бактерии |
Морфология клеток |
|
31.01 |
3.5 |
кокки, диплококки |
нейтрофилы, лизированные элементы |
|
05.02 |
3.0 |
кокки |
нейтрофилы, макрофаги |
|
07.02 |
2.5 |
кокки, цепочки стрептококков |
макрофаги, лимфоциты |
|
10.02 |
2.0 |
единичные палочки, кокки |
макрофаги, фибробласты |
|
12.02 |
1.5 |
единичные кокки |
фибробласты, эпителиоциты |
|
15.02 |
1.0 |
единичные бактероиды |
зрелые фибробласты |
|
17.02 |
0.5 |
бактерии не определяются |
эпителиальные клетки |
Бактериоскопический анализ
На 1-е и 3-и сутки в мазках выявлялись преимущественно грамо-трицательные палочки, морфологически соответствующие бактериям рода Pseudomonas и Proteus, а также кокковая флора (Staphylococcus spp.). Колонизации носили массивный характер и покрывали значительную площадь мазка.
Начиная с 5-х суток, наблюдалась тенденция к снижению бактериальной нагрузки. К 7-му дню мазки содержали преимущественно грамположительные кокки в небольшом количестве, а к 10-му дню в большинстве случаев бактериальная флора либо не определялась, либо фиксировались единичные бактериальные тела. Для оценки динамики антимикробного эффекта терапии применялся индекс бациллярной активности (БАИ). На 1-е сутки среднее значение составляло 3,6 балла (обильная бациллярная контаминация), тогда как к 10-м суткам показатель снизился до 0,6 баллов, отражая выраженное угасание бактериальной инвазии.
График 1 демонстрирует линейное снижение площади бактериальной колонизации на поверхности мазков (рисунок 1) . К 1-м суткам площадь составляла около 9,5 см², к 10-м суткам – менее 1 см².
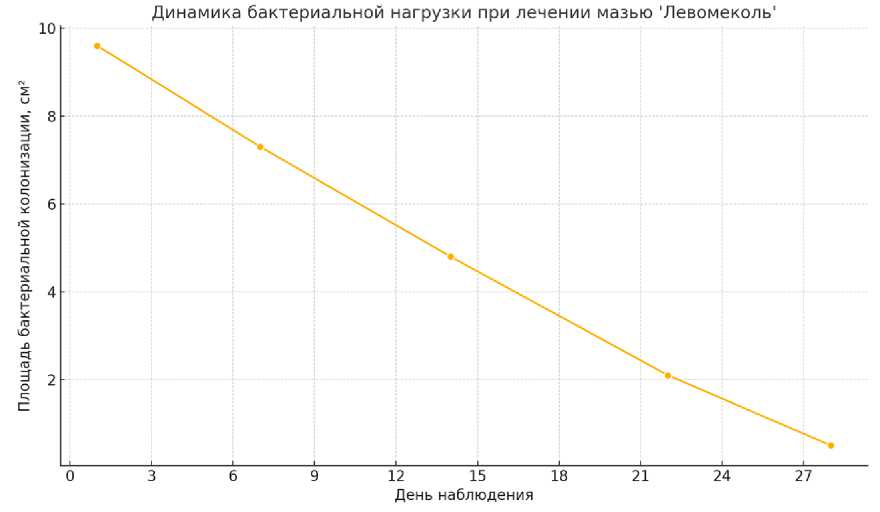
Рисунок 1 – Динамика бактериальной нагрузки при лечении мазью «Левомеколь» (площадь колонизации, см²)
График 2 отражает снижение показателей бациллярной активности: с 3,6 до 0,5 баллов по шкале, что подтверждает выраженный антисептический эффект мази Левомеколь (рисунок 2).
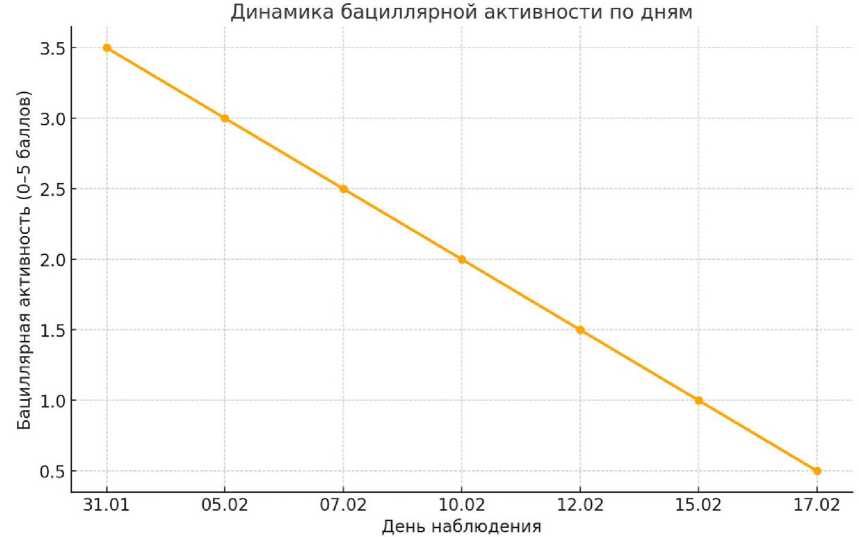
Рисунок 2 – Динамика бациллярной активности в баллах (0–5) по дням наблюдения
На 5 сутки сохранялась выраженная нейтрофильная инфильтрация (60–65 %), однако начали появляться единичные макрофаги и лимфоциты. Фон становился менее разрушенным, снижалась плотность микрофлоры (до 2–3+), преимущественно кокковой морфологии. Отмечалось уменьшение количества лизированных клеток, начались признаки фагоцитарной активности макрофагов.
К 7 суткам наблюдалась смена цитологической картины: доля макрофагов увеличивалась до 35 %, появлялись молодые фибробласты, наблюдалось снижение нейтрофилов до 25–30 %. Фон становился чище, бактериальная нагрузка снижалась до 2+, микрофлора располагалась реже и преимущественно вне клеток. Это соответствовало о фазе пролиферации, что указывало на эффективность Левомеколя в переходе от воспаления к регенерации.
На 10–12 сутки пролиферативная активность достигала максимума: макрофаги и фибробласты доминировали, нейтрофилы встречались в организации ткани. Бациллярная активность не превышала 1+. Клетки единично. Фон был представлен зрелыми эпителиоцитами, которые сохраняли чёткую морфологию, без признаков дегенерации. Это отражало активную фазу репарации тканей.
Динамика снижения бактериальной обсемененности представлена на рисунке 1 (см. рисунок 1).
К 15 и 17 суткам в мазках преобладали зрелые фибробласты и эпителиальные клетки. Бактерии отсутствовали либо присутствовали в виде единичных кокков без признаков агрессии. Цитограмма отли- чалась высокой упорядоченностью: фон чистый, клетки зрелые, признаки митотической активности минимальны. Наблюдаемая структура соответствовала поздней репаративной фазе с формированием грануляционной ткани и завершением воспаления.
На протяжении всего эксперимента наблюдалась закономерная смена морфологических типов клеток от нейтрофильного преобладания к макрофагально-фибробластическому типу, что сопровождалось последовательным снижением бактериальной нагрузки. Снижение бациллярной активности по дням наглядно показано на рисунке 2 (см. рис. 2).
Полученные цитологические данные достоверно отражают фазовую динамику раневого процесса у кроликов при использовании мази «Левомеколь». На ранних сроках (3–5 сутки) преобладание нейтрофильного звена и высокая бациллярная активность свидетельствуют о выраженном воспалительном ответе, что является типичным для начальной фазы раневого процесса. В этот период отмечается активный фагоцитоз, направленный на санацию от микробной контаминации.
Появление макрофагов и фибробластов начиная с 7-х суток указывает на переход к пролиферативной фазе, при этом снижение микробной обсемененности подтверждает эффективность антибактериального компонента мази. Цитологическая картина с доминированием макрофагов и фибробластов в сочетании с упорядоченностью фона и минимальной флорой соответствует активной фазе тканевой регенерации и формированию грануляционной ткани [7].
Сравнение с литературными источниками подтверждает высокую диагностическую ценность цитологического метода в ветеринарной хирургии [9], своевременная оценка клеточного состава и микрофлоры позволяет объективно судить о фазе воспаления, риске инфицирования и эффективности лечения. В нашем исследовании наблюдаемая последовательность фаз и снижение микробной флоры коррелируют с динамикой, описанной в указанных исследованиях, что подтверждает воспроизводимость модели.
Таким образом, мазь «Левомеколь» оказывает комплексное воздействие, направленное как на купирование воспаления, так и на стимуляцию регенерации, что находит отражение в цитологической структуре мазков. При этом следует отметить, что полученные данные демонстрируют значительное снижение бактериальной нагрузки с 9,6 до 0,5 см² в течение 28 суток (см. рисунок 1). В рамках ветеринарной экспериментальной модели мы рассматриваем эти выводы как теоретически сопоставимые, без прямой экстраполяции на клиническую практику у человека.
Выводы
-
1. Проведенное исследование позволило объективно оценить динамику репаративных и микробиологических процессов при лечении ран мазевой повязкой с препаратом Левомеколь у кроликов.
-
2. Цитологический анализ мазков-отпечатков показал фазность воспалительно-регенеративного ответа: от преобладания нейтрофильной инфильтрации на ранних сроках до формирования зрелой грануляционной ткани с доминированием макрофагов, лимфоцитов и фибробластов к 10 суткам. Нормализация клеточного состава происходила постепенно, свидетельствуя о переходе от воспаления к репарации.
-
3. Бактериоскопическая оценка позволила установить снижение общей микробной нагрузки и смену микрофлоры с преимущественным участием грамотрицательных палочек (Pseudomonas, Proteus) и грам-положительных кокков (Staphylococcus spp.) на ранних сроках, к их полному исчезновению или снижению до единичных бактериальных тел к 10 дню наблюдения.
-
4. Применение индекса бациллярной активности (БАИ) позволило стандартизировать оценку антисептической эффективности терапии. Показатель БАИ снизился с 3,6 до 0,6 балла, что демонстрирует высокую эффективность препарата в отношении поверхностной микрофлоры.
-
5. Площадь бактериальной колонизации на мазках последовательно уменьшалась с 9,5 до менее 1 см², что подтверждает достоверное снижение бактериального загрязнения под действием Левомеколя.
-
6. Метод определения родовой принадлежности бактерий по мор-фотипу и характеру окрашивания позволил идентифицировать возбудителей на уровне родов без использования дорогостоящих молекулярных тестов и бактериологических посевов, что делает подход применимым в условиях клинической ветеринарии.
-
7. На основании комплексного анализа цитологических, бактериологических и морфологических данных можно заключить, что Лево-меколь оказывает выраженное противовоспалительное и антисептическое действие, способствуя ускорению процессов регенерации.
-
8. Полученные результаты могут быть использованы в ветеринарной практике как подтверждение эффективности традиционного метода лечения гнойных и поверхностных ран у мелких животных.


