Клинико-функциональная оценка эффективности тканевых препаратов растительного происхождения у коров с травматическим ретикулитом
Автор: Макарова Е.М., Рыжаков А.В., Ошуркова Ю.Л., Магомедова В.С., Ошуркова М.Н.
Журнал: Молочнохозяйственный вестник @vestnik-molochnoe
Рубрика: Сельскохозяйственные и ветеринарные науки
Статья в выпуске: 3 (59), 2025 года.
Бесплатный доступ
В данной работе представлены результаты клинико-функционального исследования эффективности тканевых препаратов растительного происхождения при лечении травматического ретикулита у коров. В исследовании приняли участие коровы голштинизированной породы в стадии затухания третьей лактации. Лечение включало извлечение инородных тел из сетки с помощью магнитного зонда, а также последующую терапию тканевыми препаратами на основе картофеля и алоэ. Применение тканевых препаратов является эффективным дополнением к традиционному лечению травматического ретикулита у коров. Методика позволяет улучшить общее состояние животных и снизить воспаление. Исследование подчеркивает значимость мониторинга гематологических и биохимических показателей для оценки эффективности терапии. Предложенный метод может стать частью комплексной программы лечения и профилактики травматического ретикулита. Исследование открывает перспективы использования растительных тканевых препаратов в ветеринарной практике.
Коровы, экспериментальный препарат, тканевая терапия, травматический ретикулит, магнитный зонд, исследования крови
Короткий адрес: https://sciup.org/149149258
IDR: 149149258 | УДК: 636.034 | DOI: 10.52231/2225-4269_2025_3_22
Текст научной статьи Клинико-функциональная оценка эффективности тканевых препаратов растительного происхождения у коров с травматическим ретикулитом
Актуальность
Травматический ретикулит у рогатого скота представляет собой не только ветеринарную, но и актуальную экономическую проблему для хозяйств. По оценкам специалистов, заболеваемость среди коров может достигать 10 % и более, что значительно снижает продуктивность молочного скота. Заболевание зачастую сопровождается потерей аппетита, снижением молочной продуктивности и, в запущенных случаях, может приводить к летальному исходу. Эти факты подчеркивают необходимость изыскания усовершенствованных методов, как диагностики, так и лечения данного патологического состояния.
В последние годы в ветеринарии возвращается интерес к использованию забытых, но от этого не менее востребованных методов терапии и профилактики заболеваний, которым является тканевая терапия.
Тканевые препараты для лечения больных домашних животных применяли уже тогда, когда только зарождалось искусство врачевания. Теоретическое обоснование тканевой терапии дал в 1933 году академик В.П. Филатов. Однако механизм терапевтического действия тканевых препаратов изучен недостаточно. Единого мнения о механизме благотворного влияния подсадок тканей на больной организм человека и животных до настоящего времени нет [1].
Основой тканевой терапии стало учение о биогенных стимулято- рах, возникающих в результате консервации тканей как животного, так и растительного происхождения. Влияние тканевой терапии на организм осуществляется через комплекс различных механизмов и является многогранным.
Многочисленными работами было установлено, что тканевая терапия нормализует обменные процессы в организме, обладает антиоксидантными и детоксицирующими свойствами, стимулирует иммунную систему. Тканевые препараты имеют высокую биосовместимость и способны активировать процессы регенерации, способствующие восстановлению поврежденных тканей. Применение тканевых препаратов может значительно ускорить процесс выздоровления и вернуть животных в продуктивное состояние. Понимание механизмов их действия и возможности клинического применения является важным шагом к поиску эффективных методов лечения многих заболеваний [2–9, 18, 19, 20].
Важно также учесть, что использование тканевых препаратов должно сопровождаться клинической оценкой состояния здоровья животных и мониторингом реакции организма на терапию. Правильная оценка позволит не только выявить эффективность препаратов, но и разработать на основе этих данных рекомендации для их дальнейшего клинического использования.
Оценка эффективности тканевых препаратов у коров с травматическим ретикулитом представляет собой необходимую и своевременную задачу для ветеринарной медицины. Конкретные результаты исследований могут способствовать улучшению положения не только на конкретных фермах, но и в сельском хозяйстве в целом, обеспечивая ветеринарных специалистов эффективными инструментами для лечения данной патологии.
Цель данного исследования – клинико-функциональная оценка эффективности применения тканевых препаратов растительного происхождения у коров с травматическим ретикулитом по морфологическим и биохимическим показателям крови.
Материалы и методы исследования
Работа выполнена на кафедре внутренних незаразных болезней, хирургии и акушерства факультета ветеринарной медицины и биотехнологий ФГБОУ ВО Вологодская ГМХА, животноводческом предприятии ОАО «Заря» Вологодского муниципального округа.
Объектом исследований являлись коровы голштинизированной черно-пестрой породы, находящихся в стадии затухания третьей лактации.
На рисунке 1 представлена схема проведения опыта.
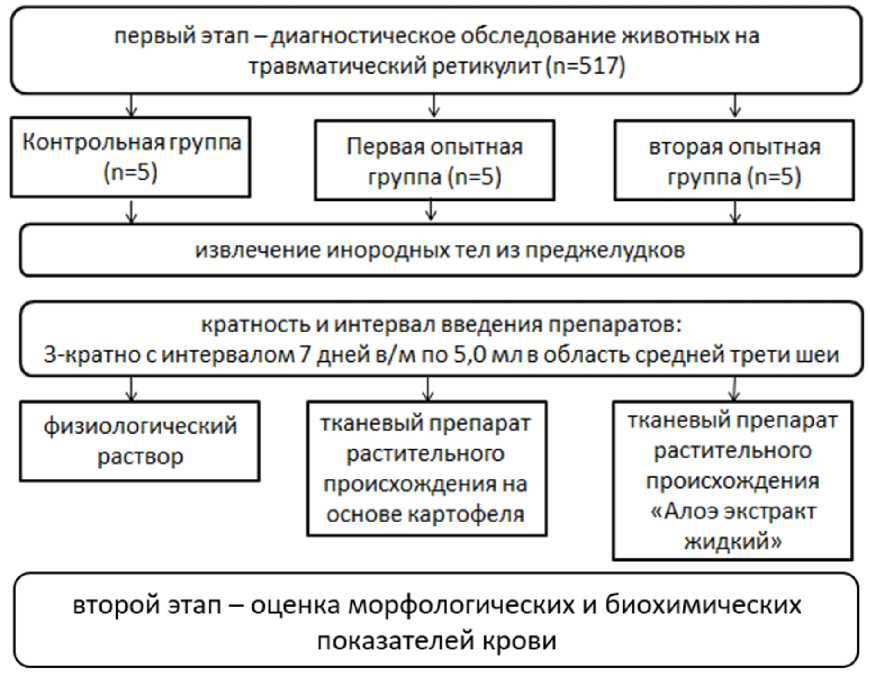
Рисунок 1 – Схема проведения опыта
Для выявления животных с травматическим ретикулитом использовали разработанную нами ранее усовершенствованную модель металлодетектора [10, 11].
При постановке животных на опыт с диагнозом травматический ретикулит сформировали три группы – контрольная, первая опытная, вторая опытная.
У животных каждой группы проведено извлечение инородных тел путем введения в сетку магнитного зонда (рисунок 2).

Рисунок 2 – Извлеченное инородное тело на головке магнитного зонда
Тканевые препараты вводили согласно схеме опыта внутримышечно в область средней трети шеи (см. рисунок 1). Животным первой опытной группы вводили тканевый препарат растительного происхождения на основе картофеля [12, 13, 14]. Животным второй опытной группы вводили тканевый препарат растительного происхождения «Алоэ экстракт жидкий» как препарат-сравнение для тканевого препарата на основе картофеля. При применении побочных явлений не наблюдалось [17]. Животным контрольной группы вводили физиологический раствор (0,9 % раствор натрия хлорида). Препараты вводили три раза с интервалом 7 дней внутримышечно по 5,0 мл в область средней трети шеи.
С целью оценки физиологического состояния организма коров проводили оценку морфологических и биохимических показателей крови за день до тканевой стимуляции, а затем на 20-й и 40-й день после нее. Морфологические и биохимические показатели крови определяли с помощью гематологического анализатора Exigo-17 и биохимического анализатора iMagic-S7.
Статистическую обработку полученных данных проводили при помощи программного обеспечения Statistica 12.0. Данные представлены в виде среднего и стандартной ошибки среднего (М ± SEM). Нормальность распределения данных оценивали при помощи критерия Шапиро – Уилка и Колмогорова – Смирнова. Для оценки достоверности различий параметров между группами в парных независимых выборках (контрольная, первая и вторая опытная группы) использовали непараметрический парный критерий Манна – Уитни, для различий параметров в парных зависимых выборках (до и после лечения) использовали непараметрический критерий Вилкоксона.
Результаты исследований и их обсуждение
Основным показателем, отражающим клинический статус животных, служит кровь. Являясь одной из центральных систем организма, она оказывает значительное влияние на его жизнедеятельность. За счёт обширной сети кровеносных сосудов и капилляров кровь контактирует с клетками всех тканей и органов, обеспечивая возможность их полноценного питания и газообмена. Вследствие этого любые внешние влияния на ткани организма незамедлительно сказываются на составе и характеристиках крови.
Для клинико-функциональной оценки эффективности применения тканевых препаратов у коров с травматическим ретикулитом провели анализ морфологических и биохимических показателей крови. Полученные результаты представлены в таблицах 1 и 2 .
Таблица 1 – Основные морфологические показатели крови коров контрольной и опытных групп
|
Показатель |
Нормальный референсный интервал1 |
Группа |
До лечения |
На 20-е сутки после лечения |
На 40-е сутки после лечения |
|
Лейкоциты, WBC, 109/L |
4,0–12,0 |
контрольная |
16,7±3,1 |
20,2±1,7**б |
16,8±2,4 |
|
1 опытная |
14,2±2,0** |
18,2±4,8 |
18,8±4,1 |
||
|
2 опытная |
19,7±2,3а |
27,9±3,6 |
23,6±5,4 |
||
|
Лимфоциты, LYM, % |
40,0–65,0 |
контрольная |
41,0±8,5 |
41,3±9,1 |
41,6±2,3 |
|
1 опытная |
47,6±3,1** |
41,4±5,0 |
38,8±5,5 |
||
|
2 опытная |
29,5±8,0 |
55,3±38,5 |
32,6±8,6 |
||
|
Гранулоциты, GRAN, % |
20,0–45,0 |
контрольная |
45,9±6,6 |
44,4±7,2** |
40,4±9,0 |
|
1 опытная |
42,6±2,6** |
43,1±5,5**б |
50,5±4,7 |
||
|
2 опытная |
58,7±7,3 |
67,5±7,3б |
54,3±6,4 |
||
|
Гемоглобин, HGB, г/л |
80–150 |
контрольная |
140,0±7,2а |
150,6±13,3б |
144,2±13,7 |
|
1 опытная |
134,8±11,5 |
137,6±11,6 |
131,2±7,2 |
||
|
2 опытная |
145,6±13,3аб |
164,8±16,9 |
166,0±17,0 |
||
|
Эритроциты, RBC, 1012/L |
5,30–10,0 |
контрольная |
7,6±0,4а |
10,0±0,5** |
8,6±1,1 |
|
1 опытная |
7,5±0,7 |
8,4±1,2** |
8,0±1,3 |
||
|
2 опытная |
8,2±0,9а |
12,3±0,5б |
9,1±1,4 |
||
|
Гематокрит, HCT, % |
24,0–46,0 |
контрольная |
33,2±1,6а |
38,4±3,9 |
35,5±4,3 |
|
1 опытная |
32,2±2,9а |
40,0±4,5 |
36,6±4,2 |
||
|
2 опытная |
33,5±3,4а |
48,4±4,9 |
40,1±5,7 |
||
|
Тромбоциты, PLT, 109/L |
100–800 |
контрольная |
236,6±106,6 |
212,6±87,6 |
207,4±78,6 |
|
1 опытная |
110,6±11,2 |
212,2±75,9 |
196,4±75,2 |
||
|
2 опытная |
141,0±60,9б |
168,0±78,8б |
200,8±62,5 |
-
* Различия с аналогичным параметром первой подопытной группы достоверны (p ≤ 0,05);
-
* * Различия с аналогичным параметром второй подопытной группы достоверны (p ≤ 0,05);
-
а Различия с аналогичным параметром на 20-е сутки взятии крови достоверны (p ≤ 0,05);
-
б Различия с аналогичным параметром на 40-е сутки взятии крови достоверны (p ≤ 0,05).
У коров первой опытной группы уровень общего числа лейкоцитов до использования тканевой терапии был ниже (14,2±2,0х109/L), чем в контрольной и второй опытной группах, и после использования тканевого препарата незначительно увеличился и не менялся, а относительное содержание лимфоцитов снижалось до 38,8±5,5х109/L. У животных второй опытной группы количество лейкоцитов изначально было высоким (19,7±2,3x109/L) и оставалось такими же высоким после курса тканевого препарата, а содержание лимфоцитов колебалось и к концу периода наблюдения оказалось значительно ниже нормативных значений (32,6±8,6х109/L). Уровень содержания гранулоцитов у животных всех групп превышал верхнюю границу нормы, что подтверждает наличие воспалительных процессов. Изменение относительного содержания гранулоцитов после лечения было неоднородно: у животных контрольной группы уровень гранулоцитов находился в пределах нормальных референсных значений, в первой опытной группе постепенно повышался до 50,5±4,7x109/L, тогда как во второй опытной группе сохранялся на уровне выше нормативных показателей .
Полученные нами данные сочетаются с данными других авторов, изучавших влияние тканевых препаратов на кровь. Тканевые препараты способствуют стабилизации или незначительному увеличению общего числа лейкоцитов, что помогает организму бороться с инфекциями и поддерживать баланс клеток иммунной системы. Однако эффект от применения препаратов зависит от исходного состояния животного: если воспалительные процессы активны, повышение лейкоцитов может оставаться заметным даже после введения препаратов. Препараты вызывают постепенное снижение концентрации лимфоцитов, особенно в опытных группах, что отражает уменьшение выраженности воспалительных процессов. Повышение уровня гранулоцитов указывает на острую фазу воспаления, и ткани часто реагируют увеличением выработки нейтрофилов и эозинофилов. Однако применение препаратов способствует постепенной нормализации показателя. Даже после завершения курсов лечения гранулоцитоз сохраняется, но уменьшается в сравнении с контролем, что является признаком уменьшения интенсивности воспалений [1, 3, 7, 8, 9].
Динамика изменения числа эритроцитов, содержания гемоглобина и гематокрита у коров контрольной и первой опытной группы выглядит нестабильной, вероятно, вызванной естественным колебанием показателей. При этом все показатели не выходили за пределы нормативных значений. У животных второй опытной группы сначала наблюдался рост числа эритроцитов, количества гемоглобина и гематокрита, превышающие референсные значения (12,3±0,5х1012/L, 164,8±16,9г/л, 48,4±4,9% соответственно), а к концу наблюдаемого периода количе ство эритроцитов и гемоглобина снизилось до нормативных значений.
Согласно некоторым научным публикациям и обзорам авторы отмечали повышение количества эритроцитов и гемоглобина в крови при использовании биогенных стимуляторов растительного происхождения, что связывают с общим активирующим влиянием на кроветворение [1, 3, 7, 8, 9].
Динамика изменений числа тромбоцитов у наблюдаемых животных во всех группах имела свои особенности, но при этом все показатели соответствовали нормативным значениям. Так, в контрольной группе наблюдали постепенное снижение числа тромбоцитов к концу периода наблюдения. У коров первой опытной группы число тромбоцитов имело тенденцию к повышению в начале опыта, а затем незначительно снизилось; а у животных второй опытной группы имелась тенденция к повышению числа тромбоцитов в течении всего периода наблюдения.
В литературе имеется немного сведений о влиянии метода тканевой терапии по В. П. Филатову на количество тромбоцитов в периферической крови. Так, ряд исследований показывает, что тканевая терапия может способствовать как повышению, так и снижению уровня тромбоцитов в зависимости от характера заболевания, состояния организма и специфики самого препарата. Также указывается, что эффекты зависят от индивидуальных особенностей организма и варьируются в зависимости от конкретного контекста применения препарата. Это подчеркивает необходимость тщательного мониторинга уровней тромбоцитов у пациентов, принимающих растительные тканевые препараты, для достижения оптимального терапевтического результата и предотвращения возможных осложнений [7].
Для оценки влияния тканевой терапии на организм коров провели оценку некоторых биохимических показателей крови.
Одним из важнейших показателей метаболизма и общего состояния у коров является энергетический обмен. Он определяет активность всех других видов обмена веществ, физиологическое состояние органов и систем, продуктивность и здоровье животных. Ведущая роль НЭЖК, глюкозы и кетовых тел в энергетическом обмене дает возможность использовать численные их значения в качестве биохимического параметра для оценки обеспеченности организма энергией [15].
Таблица 2 – Основные биохимические показатели крови коров контрольной и
|
опытных групп. |
|||||
|
Показатель |
Нормальный референсный интервал2 |
Группа |
До лечения |
На 20-е сутки после лечения |
На 40-е сутки после лечения |
|
Глюкоза, ммоль/л |
2,5–3,88 |
контрольная |
3,74±0,08 |
3,82±0,11б |
3,14±0,21 |
|
1 опытная |
3,84±0,17б |
3,76±0,18 |
3,12±0,17 |
||
|
2 опытная |
3,98±0,12б |
3,92±0,21б |
2,92±0,22 |
||
|
Кетоновые тела, мг% |
9,0–13 |
контрольная |
8,65±0,77* |
10,35±2,27 |
7,20±0,66* |
|
1 опытная |
10,85±0,98** |
10,60±0,68** |
10,15±1,43** |
||
|
2 опытная |
7,95±0,50 |
7,65±0,38 |
6,65±0,79 |
||
|
НЭЖК, мг-экв/мл |
0,3–0,55 |
контрольная |
0,36±0,02* |
0,39±0,11* |
0,29±0,07 |
|
1 опытная |
0,48±0,07**а |
0,19±0,02**б |
0,38±0,07 |
||
|
2 опытная |
0,34±0,01 |
0,50±0,08 |
0,30±0,05 |
||
|
Общий белок, г% |
8,3–8,8 |
контрольная |
8,34±0,16 б |
8,51±0,17б |
7,89±0,26 |
|
1 опытная |
8,32±0,32 |
8,35±0,11 |
8,06±0,23 |
||
|
2 опытная |
8,51±0,39 б |
8,28±0,29 б |
7,77±0,41 |
||
|
Мочевина, ммоль/л |
3,3–6,7 |
контрольная |
6,00±0,49аб |
4,80±0,41 |
4,52±0,41* |
|
1 опытная |
5,34±0,76 |
5,62±0,46б |
4,54±0,40* |
||
|
2 опытная |
6,18±0,82а |
4,64±0,35 |
6,00±0,45 |
||
|
Кальций, ммоль/л |
2,6–3,8 |
контрольная |
2,38±0,05аб |
1,96±0,02 |
2,21±0,09 |
|
1 опытная |
2,40±0,05а |
1,98±0,04б |
2,28±0,05 |
||
|
2 опытная |
2,55±0,08аб |
1,98±0,08 |
2,16±0,08 |
||
|
Фосфор, ммоль/л |
1,29–2,1 |
контрольная |
1,73±0,10 |
1,67±0,13 |
1,75±0,10 |
|
1 опытная |
1,84±0,04 |
1,67±0,06 |
1,83±0,04 |
||
|
2 опытная |
1,89±0,03а |
1,63±0,07 |
1,64±0,17 |
-
* Различия с аналогичным параметром первой подопытной группы достоверны (p ≤ 0,05);
-
* * Различия с аналогичным параметром второй подопытной группы достоверны (p ≤ 0,05);
а Различия с аналогичным параметром на 20-е сутки взятии крови достоверны (p ≤ 0,05);
-
б Различия с аналогичным параметром на 40-е сутки взятии крови достоверны (p ≤ 0,05).
Уровень глюкозы в плазме крови у животных контрольной и первой опытной групп менялся незначительно и сохранялся примерно на одном уровне. У коров второй опытной группы мы наблюдали незначительное снижение уровня глюкозы, который не выходил за пределы нормативных значений.
При оценке содержания кетоновых тел в разных группах динамика показателя варьировалась. Так, у животных контрольной группы, в начале опыта мы наблюдали сначала повышение содержания уровня кетоновых тел в крови, а затем, к концу опыта, снижение их содержания за пределы нормативных значений (до 7,20±0,66мг%). У коров первой опытной группы уровень кетоновых тел менялся незначительно и находился примерно на одном уровне в пределах референсных значений. У животных второй опытной группы уровень кетоновых тел был самый низкий и к концу наблюдаемого периода имел тенденцию к снижению (от 7,95±0,50 до 6,65±0,79мг%).
Исходя из полученных нами данных при оценке энергетического обмена, видно, что уровень НЭЖК у всех животных был в пределах нормативных значений в начале опыта, при этом самый высокий уровень НЭЖК был у животных первой опытной группы (0,48±0,07мг-экв/ мл). В процессе наблюдения за животными мы видим, что уровень колебания НЭЖК у животных контрольной и второй опытной группы был идентичным, сначала отмечали незначительное повышение уровня показателя, а затем его снижение; при этом все значения находились в пределах рефенсных значений. У животных первой опытной группы уровень НЭЖК в начале опыта снижался (0,19±0,02мг-экв/мл), а затем повышался до 0,38±0,07мг-экв/мл.
При этом в литературе имеются сведения о стимулирующем влиянии тканевых препаратов растительного происхождения на углеводный обмен и повышение концентрации глюкозы в крови. Повышение глюкозы связывают с улучшением процессов гликолиза и глюконеогенеза. В результате снижается дефицит энергии, что предотвращает избыточный распад жиров и ограничивает чрезмерное образование кетоновых тел. За счет этого обеспечивается повышение общей энергетической устойчивости организма, что помогает коровам быстрее восстанавливаться после стрессов или заболеваний [3, 4, 5].
Анализ содержания общего белка и мочевины в крови коров позволяет составить объективную картину состояния белкового обмена у животных. Так, в начале опыта и на 20-е сутки опыта концентрация общего белка у животных всех групп достоверно находилась на одном уровне и соответствовала референсным значениям. К концу опыта уровень общего белка снизился у коров контрольной и второй опытной групп. Уровень мочевины в крови коров всех групп на протяжении всего периода наблюдения находился в пределах нормы и имел тенденцию к снижению. Однако более выраженные изменения были у животных контрольной группы (наблюдали снижение содержания мочевины от 6,00±0,49 до 4,52±0,41 ммоль/л) и первой опытной группы (изменения содержания мочевины варьировали от 5,34±0,76 до 4,54±0,40 ммоль/л).
В научных работах некоторых авторов имеются сведения о влиянии тканевой терапии на белковый обмен. При этом авторы отмечают, что под влиянием тканевых препаратов стимулируется синтез белков, повышается уровень общего белка в сыворотке крови и регенеративных процессов в тканях [1, 3, 9].
Уровень кальция и фосфора в плазме определяется для оценки состояния минерального обмена. Кальций и фосфор тесно связаны в метаболизме: кальций участвует в формировании структур костей и внеклеточных процессов, а фосфор является компонентом нуклеиновых кислот и энергетического обмена.
В ходе исследования концентрация кальция в крови коров обеих опытных групп оставалась стабильно ниже нормативных значений на протяжении всего периода наблюдения. На момент завершения лечения уровень кальция в первой опытной группе составил 2,28 ммоль/л, что ниже нормы на 12,3 %, а во второй опытной – 2,16 ммоль/л, ниже нормы на 16,8 %. Пониженный уровень кальция может быть обусловлен нарушениями обмена веществ при травматическом ретикулите. В отличие от кальция, уровень фосфора в крови существенно не изменялся в течение всего исследования и находился в пределах нормы, что свидетельствует о сохранении баланса этого макроэлемента в организме животных при рассматриваемом лечении. Поддержание нормального уровня фосфора служит положительным фактором для метаболических процессов, в то время как дефицит кальция требует внимания для предотвращения дальнейших осложнений и поддержания молочной продуктивности.
Заключение
Важным моментом при лечении травматического ретикулита является необходимость комплексного подхода к лечению, включая диагностику, извлечение инородных тел и последующую медикаментозную терапию. Полученные результаты подтверждают целесообразность использования тканевых препаратов в ветеринарной практике для лечения травматического ретикулита. Это также открывает перспективы для дальнейших исследований по оптимизации дозировок и схем применения данных препаратов. Разработка новых методов терапии позволит повысить экономическую эффективность молочного скотоводства. Поддержание здоровья животных напрямую влияет на качество и количество производимого молока. Следует учитывать индивидуальные особенности животных и этап заболевания при назначении лечения. Регулярный мониторинг гематологических и биохимических показателей является ключом к успешной терапии.
Итоговые данные свидетельствуют о необходимости дальнейшего изучения механизмов действия тканевых препаратов. Включение этих препаратов в комплексные программы лечения позволит улучшить состояние здоровья коров и повысить продуктивность животноводческих ферм. В целом, результаты исследования подтверждают перспективность тканевой терапии как эффективного метода при травматическом ретикулите у коров.


