Перспективы внутрипузырного способа введения таргетных препаратов при раке мочевого пузыря
Автор: Боженко В.К., Кулинич Т.М., Кудинова Е.А., Гончарова О.И., Джикия Е.Л.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Обзор
Статья в выпуске: 4 т.25, 2025 года.
Бесплатный доступ
Проблема повышения эффективности химиотерапевтического лечения рака мочевого пузыря представляет собой одну из ключевых задач современной онкологии. Несмотря на достигнутые успехи в разработке новых препаратов и методов терапии, рецидивирование заболевания остается высоким, особенно среди пациентов с поверхностными формами опухоли. Одним из перспективных подходов является выбор оптимального пути доставки лекарственных веществ непосредственно в мочевой пузырь пациента посредством внутрипузырного введения цитостатических агентов. Современные исследования показывают, что эффективность такого метода обусловлена локальным достижением высоких концентраций препарата в непосредственной близости от опухолевых клеток, минимизацией побочных эффектов системной токсичности и возможностью предотвращения распространения метастазов. Однако данная методика имеет ряд ограничений, обусловленных необходимостью индивидуального подбора схемы лечения, зависимостью результата от характеристик опухоли и индивидуальной чувствительности организма пациента. Таким образом, дальнейшее изучение механизмов взаимодействия химиопрепаратов с клетками опухоли, разработка персонализированных схем терапии и совершенствование техники внутрипузырного введения являются приоритетными направлениями научных исследований в области урологической онкологии. Эти меры позволят существенно повысить качество оказания медицинской помощи пациентам с раком мочевого пузыря и снизить показатели смертности от данного заболевания.
Рак мочевого пузыря, таргетные препараты, внутрипузырное введение, молекулярные мишени таргетной терапии, клинические исследования
Короткий адрес: https://sciup.org/149150002
IDR: 149150002 | DOI: 10.24412/1999-7264-2025-4-130-140
Текст научной статьи Перспективы внутрипузырного способа введения таргетных препаратов при раке мочевого пузыря
Мочевой пузырь — это жизненно важный полый орган, который отвечает за накопление и выделение мочи. Среди различных заболеваний мочевого пузыря, таких как циститы, образование камней и опухолей, наибольшую угрозу представляет рак мочевого пузыря (РМП). РМП является наиболее распространённым злокачественным новообразованием в мочевыводящей системе. Ежегодно в мире регистрируется свыше 400 тысяч новых случаев РМП, и более 200 тысяч пациентов умирают от этого заболевания [1].
При первичном обращении около 75% случаев рака мочевого пузыря (РМП) классифицируются как поверхностные или немышечно-инвазивные (НМИРМП). Это означает, что опухоль ещё не успела проникнуть в мышечный слой стенки мочевого пузыря или дать метастазы. Такой характер заболевания обеспечивает достаточно высокий процент пятилетней выживаемости при РМП. Однако примерно у 25% пациентов уже при первом обращении опухоли оказываются мышечно-инвазивными (МИРМП) [1,2].
Несмотря на то что в стандартной практике лечения НМИРМП используется комплексный подход, включающий трансуретральную резекцию опухоли мочевого пузыря (ТУР-БП) и дополнительную химиотерапию или иммунотерапию, показатели рецидивов и прогрессирования остаются довольно высокими [3,4]. Одной из причин этого является то, что после хирургического вмешательства действующее вещество лекарственного препарата не достигает необходимой концентрации в месте локализации опухоли, что затрудняет эффективное уничтожение остаточных опухолевых клеток [5].
Поэтому разработка новых методов доставки лекарственных средств, позволяющих достичь оптимальной концентрации препарата в очаге поражения, является актуальной и важной клинической задачей [3].
Проблема повышения эффективности химиотерапии и выбора способа введения препарата при лечении РМП
Наиболее распространёнными способами введения противоопухолевых препаратов являются внутривенное и пероральное применение. Однако эффективность накопления препарата в зоне опухоли ограничена рядом процессов: метаболизм, выведение через почки и побочные реакции. В связи с этим, системное введение лекарств не всегда подходит для эффективной доставки в мочевой пузырь [6, 7].
Поэтому внутрипузырное введение лекарственных средств (ВПВ) становится наилучшим вариантом лечения РМП. Этот метод позволяет вводить одно или несколько лекарственных соединений непосредственно в полость мочевого пузыря через уретру с помощью катетера или шприца. Благодаря этому воздействие препарата на поражённую область значительно усиливается, что позволяет использовать меньшие дозы и снижает риск побочных эффектов [3,8].
В настоящее время внутрипузырная терапия (ВПТ) широко используется в клинической практике как метод постоперационной адъювантной терапии при лечении НМИРМП. Кроме того, она находит применение и в неоадъювантной терапии, которая назначается перед операцией при МИРМП с целью снижения степени тяжести патологии и улучшения прогноза заболевания [9,10].
Следует отметить, что сочетание доставки препаратов с использованием специальных носителей и метода ВПВ продемонстрировало более эффективные результаты по сравнению с инъекционным введением непосредственно в опухоль или системной терапией (Рис. 1). Тщательно разработанный дизайн систем доставки лекарственных средств придает ВПВ дополнительные синергические эффекты и особые преимущества [11–13].
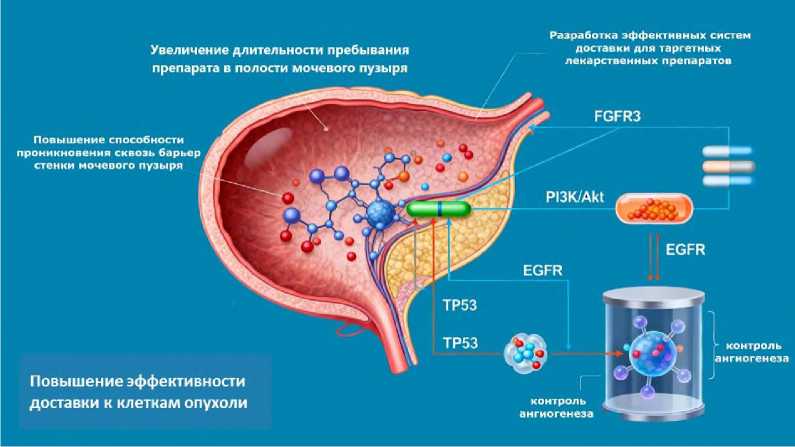
Рис. 1. Принципы создания таргетных препаратов для внутрипузырной терапии при РМП. Основные молекулярные мишени в отношении которых ведутся разработки лекарственных противоопухолевых средств.
Однако существуют и ограничения ВПВ: лекарственные средства, вводимые через уретру, подвергаются разбавлению и вымыванию непрерывно образующейся мочой, что негативно влияет на стабильность препаратов; стенки мочевого пузыря представляют собой естественные барьеры проницаемости, что ограничивает доставку действующих веществ непосредственно к месту поражения. Современные методики обычного интравезикального введения традиционных препаратов пока недостаточно эффективны для удовлетворения терапевтических потребностей при заболеваниях мочевого пузыря, особенно при РМП. Также следует учитывать дискомфорт пациентов при данной терапии вследствие многократных процедур установки катетера [11,14].
Предлагаются различные стратегии преодоления вышеуказанных ограничений, сосредоточенные на трёх главных направлениях:
-
1. Увеличение длительности пребывания препарата в полости мочевого пузыря.
-
2. Повышение способности проникновения сквозь барьер стенки мочевого пузыря.
-
3. Разработка эффективных систем доставки для таргетных лекарственных препаратов.
Доставка лечебных препаратов и особенности физиопатологии мочевого пузыря играют ключевую роль при проектировании новых систем интравезикальной доставки лекарственных средств (СИДЛС). В настоящее время активно разрабатываются способы и системы для локальной, направленной и замедленной доставки препаратов с использованием специализированных носителей, таких как наночастицы или микросферы [15,16].
Потенциальные преимущества и недостатки внутрипузырного введения таргетных препаратов
Основные преимущества ВПВ:
-
1. При ВПВ существует возможность достичь максимальной локальной концентрации ЛП, что позволит повысить его эффективность. При ВПВ препарат доставляется непосредственно к опухолевым клеткам, выстилающим мочевой пузырь. Это позволяет создать чрезвычайно высокую локальную концентрацию, которая была бы токсична при системном введении. Таким образом, можно использовать препараты, которые при пероральном приеме плохо переносятся или не достигают достаточной концентрации в мочевом пузыре из-за системного метаболизма [15,16].
-
2. Слизистая мочевого пузыря обладает относительно низкой всасывающей способностью, особенно для крупных молекул. Это сводит к минимуму попадание мощного таргетного препарата в кровоток, что позволяет избежать системных побочных эффектов, характерных для этих же препаратов при приеме внутрь (например, миелосупрессия, желудочно-кишечные токсичности для ингибиторов CDK4/6; кожные высыпания, диарея для ингибиторов EGFR и т.д.). При ВПВ системная токсичность минимальна, и это главный аргумент в пользу любой внутрипузырной терапии [17].
-
3. Воздействие на «поле злокачественной трансформации» (Field Effect). Раствор таргетного препарата, заполняющий мочевой пузырь, может воздействовать не только на видимую опухоль, но и на микроскопические неоплазии и генетически измененные клетки по всей его поверхности, предотвращая рецидивы. С учетом того, что весь уротелий мочевого пузыря у пациентов с РМП часто генетически нестабилен и предрасположен к образованию новых опухолей, данный факт позволяет добиться снижения риска отдаленных рецидивов [18].
-
4. Преодоление резистентности к стандартной терапии. У ряда пациентов после нескольких курсов развивается резистентность к БЦЖ или химиотерапии (митомицин С, доксорубицин). Таргетные препараты, действующие на конкретные молекулярные пути опухоли (например, путь FGFR3 при папиллярных опухолях или путь p16-Rb при CIS), могут быть эффективны в случаях появления резистентности к стандартным химиопрепаратам [19].
-
5. Таргетные препараты являются идеальной платформой для персонализированной медицины. После трансуретральной резекции (ТУР) опухоли и ее молекулярного профилирования с помощью секвенирования или иммуногистохимическими методами существует возможность определения молекулярно-биологических маркеров для данной конкретной опухоли. При выявлении таких мишеней (например, мутация FGFR3 , потеря p16, гиперэкспрессия EGFR) пациенту может быть назначен соответствующий таргетный препарат, непосредственно вводимый в полость мочевого пузыря [19–21].
Потенциальные проблемы и недостатки ВПВ
-
1. Непосредственная доставка препарата к опухолевым клеткам может быть осложнена за счет наличия гликокаликсного слоя на поверхности уротелия и массы опухолевой ткани, которые могут мешать проникновению препарата. Для решения этой проблемы активно исследуются варианты систем, способных повысить эффективность доставки: липосомы, полимерные наночастицы, которые «загружаются» препаратом и способны проникать вглубь ткани. Также разрабатываются соединения, способные усилить проницаемость — вещества, которые временно увеличивают проницаемость слизистой оболочки для улучшения доставки [22,23].
-
2. Существенной проблемой для лечения онкологических заболеваний в целом является гетерогенность опухоли. Внутри одной опухоли могут существовать клоны клеток с разными молекулярными профилями. Таргетный препарат против одной мишени может уничтожить только часть опухоли, оставив другую часть нетронутой, что в дальнейшем приведет к рецидиву [24,25].
-
3. Экономическая проблема разработки и введения препаратов в клиническую практику. Зачастую фармкомпании не заинтересованы в разработке внутрипузырной формы дорогостоящего таргетного препарата из-за ограниченного рынка (только одна нозология) и высоких затрат на клинические исследования. Требуются отдельные клинические исследования для подтверждения эффективности и безопасности именно местного способа введения [2,3].
-
4. Риск локальной токсичности. Хотя системная токсичность минимальна, присутствует вероятность возникновения раздражения слизистой мочевого пузыря (химический цистит), дизурии, гематурии. В настоящее время еще мало клинических данных о переносимости мощных таргетных агентов при локальном способе введения [25,26].
Преимущество у внутрипузырного введения таргетных препаратов, безусловно, есть, и оно заключается в уникальном сочетании максимальной эффективности на месте болезни с минимальным системным воздействием на организм. Это направление считается одним из самых перспективных в лечении немышечно-инвазивного рака мочевого пузыря (NMIBC). Однако на пути его широкого внедрения стоят технологические барьеры (эффективная доставка препаратов к опухолевым клеткам) и коммерческие сложности. Активные доклинические и ранние клинические исследования в этой области дают надежду на появление таких препаратов в арсенале урологов в будущем.
Возможности внутрипузырного введения лекарственных препаратов в зависимости от варианта РМП
Преимущество у внутрипузырного введения таргетных препаратов, безусловно, есть, и оно заключается в уникальном сочетании максимальной эффективности на месте болезни с минимальным системным воздействием на организм [3,7,10]. В таблице 1 представлены возможные варианты и предполагаемые преимущества использования внутрипузырного способа введения таргетных препаратов в зависимости от стадии РМП.
Табл. 1. Преимущества внутрипузырного введения в зависимости от варианта РМП
|
Вариант / Стадия РМП |
Преимущество внутрипузырного введения |
Предпочтительный режим (гипотетический / исследуемый) |
|
1. NMIBC: Низкий риск (Ta, G1) |
Сомнительное. Стандартная однократная химиотерапия (митомицин С) после ТУР эффективна и дешева. |
Шаблонный режим. Однократная инстилляция химиопрепарата после ТУР. Таргетная терапия не оправдана. |
|
2. NMIBC: Высокий риск (T1, G3, CIS) |
Максимальное. Необходимость в длительном, эффективном и хорошо переносимом лечении для предотвращения прогрессии и цистэктомии. |
Персонализированный, длительный режим на основе молекулярного профиля опухоли. Например, при мутации FGFR3 – инстилляции ингибитора FGFR; при потере p16 – ингибитора CDK4/6. Курс может длиться 1–3 года. |
|
3. Рефрактерный CIS |
Критическое. Когда БЦЖ и химиотерапия не работают, а цистэктомия – единственный вариант. |
"Спасительный" комбинированный режим. Например, комбинация ингибитора контрольной точки (анти-PD-L1) + таргетного препарата (например, против EGFR) для одновременной атаки на опухоль и иммунитет. |
|
4. MIBC (мышечноинвазивный) |
Вспомогательное (неоадъювантное). Может использоваться ДО цистэктомии для уменьшения объема опухоли и воздействия на внутриэпителиальные изменения. |
Короткий, интенсивный неоадъювантный курс: 4-6 недель инстилляций перед операцией, направленный на основную молекулярную мишень опухоли. |
Если рассматривать более конкретно каждый из вариантов, то для НМИРМП (NMIBC) низкого риска (Low-Grade, Ta) преимущество внутрипузырной таргетной терапии слабое или практически отсутствует. Риск прогрессии у этих опухолей крайне низок (<5%). Стандартная однократная послеоперационная инстилляция химиопрепарата (митомицин С, гемцитабин) эффективно снижает риск рецидива, проста в применении и недорога. Предпочтительным режимом в случае НМИРМП (NMIBC) низкого риска остается стандартная внутрипузырная химиотерапия. Использование более сложных и дорогих таргетных препаратов экономически и клинически нецелесообразно [12,27].
При варианте НМИРМП высокого риска (High-Grade T1, CIS, рецидивирующие G3) возможный эффект использования ВПВ таргетной терапии максимальный. Данный вариант РМП, с учетом недостатков стандартных методов лечения, это основная «ниша» для будущего применения таргетной терапии [28]. Целями в данном случае являются предотвращение необходимости цистэктомии и прогрессии в MIBC. Предположительно наиболее продуктивными режимами могут являться персонализированный выбор мишени и длительный курс таргетного препарата. Алгоритм лечебной тактики имеет в данном случае следующий вид:
Шаг 1: После ТУР опухоль отправляется на расширенное патомолого-молекулярное исследование (NGS (Next-Generation Sequencing, секвенирование нового поколения), иммуногистохимия).
Шаг 2: Выбор препарата на основе выявленной мишени:
-
- при наличии мутации/активации FGFR3 : Внутрипузырный эрдафитиниб или аналогичный ингибитор FGFR. Это идеальный сценарий для папиллярных опухолей.
-
- при потере p16INK4a или амплификации Cyclin D1: Внутрипузырный ингибитор CDK4/6 (например, гипотетический MMD37K или аналоги).
-
- при гиперэкспрессии EGFR: Внутрипузырный гефитиниб или другие ингибиторы EGFR.
-
- при наличии CIS и отсутствии явной мишени: Внутрипузырная иммунотерапия (анти-PD-L1) для активации локального иммунного ответа.
Режим введения: Индукционный курс (еженедельно в течение 6 недель), затем длительная поддерживающая терапия (ежемесячно в течение 1–3 лет) для постоянного подавления рецидивов.
В случаях рефрактерного рака in situ (CIS) и опухолей, устойчивых к БЦЖ, возможность использования внутрипузырной таргетной терапии приобретает критическое значение. У этих пациентов варианты лечения исчерпаны, и следующим шагом является радикальная цистэктомия. Внутрипузырная таргетная терапия — это последний шанс сохранить орган. Предпочтительным режимом в таком случае будет являться достаточно агрессивная комбинированная химиотерапия, т. к. из-за высокой злокачественности и гетерогенности таких опухолей монотерапия, с высокой степенью вероятности, будет недостаточной [11,29,30]. Примером режима может являться комбинация ингибитора контрольной точки (например, атезолизумаба) + таргетного препарата (например, ингибитора CDK4/6) [31,32]. Такая схема позволит добиться синергетического эффекта: таргетный препарат напрямую убивает опухолевые клетки с конкретной мишенью, а иммунотерапия «снимает тормоза» с иммунной системы, позволяя ей атаковать остальные клетки опухоли, в том числе с другими молекулярными портретами [30,31].
В случае мышечно-инвазивного РМП (МИРМП, MIBC) наибольшую эффективность таргетная терапия может оказать при неоадъювантном лечении. В данном случае ее применение будет скорее вспомогательным, но при правильном подходе может являться потенциально революционным. Стандартом лечения при МИРМП является неоадъювантная системная химиотерапия с последующей цистэктомией. Однако системная химиотерапия токсична и не всеми пациентами хорошо переносится [28,32]. Предпочтительным режимом таргетной терапии с ВПВ в случае МИРМП будет являться короткий интенсивный неоадъювантный курс. Для определения молекулярной мишени после подтверждения диагноза MIBC и перед планируемой операцией пациенту должно быть проведено молекулярное тестирование тканей опухоли [33]. Далее в течение 4–6 недель проводится курс внутрипузырных инстилляций таргетного препарата, направленного на основную выявленную «драйвер»-мутацию опухоли. Основной целью в данном случае будет являться уменьшение внутрипузырного компонента опухоли, подавление роста злокачественных клеток в поверхностных слоях уротелия и, возможно, в наилучшем варианте, патоморфологический регресс, что позволит сократить объем хирургического вмешательства и улучшит последующий прогноз течения заболевания.
Заключение
Проведенный анализ наиболее актуальной научной литературы, посвященной теме разработки и использования таргетных препаратов при РМП, в том числе при внутрипузырном способе введения, показал, что максимальной эффективностью будет являться ВПВ при лечении агрессивных форм NMIBC (высокий риск, CIS), где стоит задача долгосрочного контроля заболевания с сохранением органа и минимальной токсичностью. При выборе стратегии лечения важен индивидуальный подход. Предпочтительный режим и способ введения препаратов определяются на основе молекулярного портрета опухоли и могут включать как монотерапию, так и комбинации препаратов для преодоления резистентности.
Вклад авторов. Разработка концепции исследования, анализ и интерпретация результатов — Боженко В.К.; анализ литературы, написание статьи — Кулинич Т.М.; подбор и систематизация публикаций — Гончарова О.И.; написание текста и корректировка публикации — Кудинова Е.А.; написание разделов статьи и оформление — Джикия Е.Л.
Финансирование. Исследования выполнены при поддержке Министерства здравоохранения Российской Федерации, тематика государственного задания № 1024101400019-9-3.2.21.
Соблюдение прав пациентов и правил биоэтики. Данное обзорное исследование было основано на опубликованных работах и поэтому не требовало одобрения этического комитета.


