Влияние гипо- и гипертермии на коагуляционный гемостаз коров и кур in vitro
Автор: Фомина Л.Л., Рычкова Е.А., Киселева С.Д., Цыганок А.А.
Журнал: Молочнохозяйственный вестник @vestnik-molochnoe
Рубрика: Сельскохозяйственные и ветеринарные науки
Статья в выпуске: 1 (53), 2024 года.
Бесплатный доступ
Коагулограмма относится к важнейшим диагностическим методам оценки физиологического состояния животных. Установлено, что при гипертермии in vitro в плазме крови коров происходит гиперкоагуляция, сопровождающаяся укорочение тромбинового (ТВ) и протромбинового времени (ПВ), а при гипотермии активируется противосвертывающая система. У кур активация свертывания крови и снижение активности антитромбина выявлены как при гипертермии (46°С), так и при гипотермии (18°С). Между показателями коагуляционного гемостаза и температурой инкубации плазмы коров обнаружена отрицательная корреляция от умеренной до заметной. У кур отметили высокую зависимость от температуры только тромбинового времени. Сравнивая реакцию показателей коагулограммы коров и кур на изменение температуры инкубации плазмы, можно отметить однотипность реакций тромбинового и активированного частичного тромбопластинового времени и совершенно разные реакции протромбинового времени, активности фибриногена и антитромбина у этих животных.
Коровы, куры, кровь, температура инкубации плазмы крови, гемостаз
Короткий адрес: https://sciup.org/149145818
IDR: 149145818 | УДК: 636:612.115:619 | DOI: 10.52231/2225-4269_2024_1_107
Текст научной статьи Влияние гипо- и гипертермии на коагуляционный гемостаз коров и кур in vitro
Нарушение гемостаза является патогенетической основой многих болезней [1] и летальных исходов у кур и крупного рогатого скота, а также других животных, в связи с чем актуальна разработка диагностических, профилактических и терапевтических методов нормализации гемостаза у животных. Температура тела является одним из важнейших параметров гомеостаза, а также фактором регуляции функционирования живых систем [2]. Изменения системы гемостаза при гипертермическом воздействии широко изучается фундаментальной медициной в связи с успешным применением данного воздействия при лечении онкологических, аллергических, аутоиммунных и инфекционных заболеваний [3].
В связи с тем, что продуктивные животные и птицы имеют температуру тела, сильно отличающуюся от человеческой, методы оценки гемостаза, принятые в гуманной медицине могут не подходить для оценки гемостаза животных, но поскольку гемостазиологические оценки постепенно становятся важными для диагностики здоровья животных и для углубления существующих представлений о клеточных механизмах адаптации организма к температурным режимам, адаптированная и стандартизированная методология анализа свертывания крови продуктивных животных важна и срочно необходима [4].
Цель работы – определение зависимости скорости коагулологических реакций крови продуктивных животных от температуры инкубации плазмы.
Задачи исследования:
определить показатели коагуляционной активности крови коров in vitro при гипо- и гипертермии;
оценить показатели коагуляционной активности крови кур in vitro при гипо- и гипертермии;
провести корреляционно-регрессионный анализ полученных данных.
Материалы и методы
Работа выполнена в 2023 г. в Вологодской ГМХА имени Н.В. Верещагина при финансовой поддержке Российского научного фонда № 23-26-00115,
В исследовании использовали кровь 15 здоровых коров айрширской породы ( Bostaurus L., 1758) с привязным содержанием, в возрасте от 4 до 6 лет, разных стадий лактации и живой массой 400–480 кг, принадлежащих СПК «Агрофирма Красная Звезда» Вологодского района, и 19 здоровых кур-несушек ( Gallusgallus L., 1758), породы Род-Айленд красная, кросс Хайсекс Браун, принадлежащих СХПК «Племптица-Можайское», возрастом 2 года и весом 1900 г. Птица содержалась в четырехъярусных клетках производства компании «VALLI».
У птиц кровь получали в стеклянные пробирки, содержащие 3,8%-ный раствор цитрата натрия в соотношении 1:9 пункцией подкрыльцовой вены.
Отбор проб крови у коров проводился в вакуумные пробирки IMPROVACUTER, содержащие 3,8%-ный раствор цитрата натрия в соотношении 1:9 из хвостовой вены.
Объектом исследования являлась бедная тромбоцитами плазма, полученная в результате центрифугирования крови при 3000 оборотов в минуту в течение 20 мин [5, 6].
Для оценки состояния плазменно-коагуляционного гемостаза определяли следующие показатели: АЧТВ (активированное частичное тромбопластиновоевремя),ПВ(протромбиновоевремя),ТВ(тромбиновое время) и анализ активности фибриногена [7, 8]. Эти тесты основаны на триггерных реагентах, вызывающих образование фибринового сгустка в образце в присутствии фосфолипидов и кальция. Тромб обнаруживали механическим способом, основанным на измерении времени с момента внесения реагента, запускающего ферментативный процесс свертывания, до момента коагуляции (клоттинговыми методами) при температуре 37°С на коагулометре «Thrombostat» производства BehnkElektronik (Германия) и мануально (при периодическом покачивании пробирки) с использованием термостата медицинского водяного, серии TW: TW-2 (ELMI TW-2) при температуре 43°C, 40°C, 28°C, 24°C и 18°C . Были использованы медицинские наборы: «Тромбо-тест», «Техпластин-тест», «АПТВ-тест», «РФМК-тест планшетный вариант» и активность фибриногена (НПО РЕНАМ, Россия). Все исследования проводились в соответствии с инструкциями к реагентам [7, 8].
Антикоагуляционные свойства крови оценивали по активности Антитромбина III в плазме с помощью Тех-Антитромбин-теста при 18°C, 24, 28, 37, 40, 43°C. Принцип метода состоял в том, что Антитромбин III из плазмы, подвергнутой тепловому дефибринированию, инактивировал α-тромбин. Тестировали остаточную активность тромбина через 2 мин от начала инкубации дефибринированной плазмы с тромбином при разных температурах. По времени свёртывания оценивали активность Антитромбина III образца (принцип U.Abildgaard в модификации А.П. Момота и А.Н. Мамаева) [8].
Нормальность распределения данных оценивали при помощи критерия Шапиро-Уилка и Колмогорова-Смирнова. Для оценки достоверности различий параметров между видами в парных независимых выборках использовали критерий Манна-Уитни, для различий параметров при разных температурах в множественных зависимых выборках использовали критерий Вилкоксона. Силу парной линейной связи между переменными оценивали при помощи непараметрического коэффициента корреляции Спирмана (R). Качественную интерпретацию силы связи между показателями коагулограммы и температурой инкубации плазмы выполняли на основе шкалы Чеддока. Влияние температурного фактора оценивали с помощью теоретического коэффициента детерминации (R 2 ). Проверка статистической значимости коэффициентов корреляции осуществлялась с помощью статистического критерия Фишера (однофакторный дисперсионный анализ, One-way ANOVA) [9].
Результаты исследований
Исследования in vitro плазмы коров показали, что гипо- и гипертермия приводили к изменению каскада коагуляции (табл. 1).
Таблица 1 - Сравнительный анализ показателей гемостаза коров при разных температурах
|
Показатель (n=15) |
18 |
Температура, °С |
||
|
37 |
40 |
43 |
||
|
ТВ, с |
50,09±6,22dg |
26,54±1,74afg |
45,17±4,63dg |
18,01±2,11adf |
|
ПВ, с |
89,51±12,79dfg |
55,13±13,68ag |
34,57±1,68ag |
24,88±2,58adf |
|
АЧТВ, с |
353,09±14,89dfg |
62,83±2,34a |
64,31±6,85a |
88,91±29,19a |
|
Активность фибриногена, с |
130,15±27,00 dfg |
12,46±1,20 afg |
23,90±5,67 ad |
24,77±5,45 ad |
|
Антитромбин, с |
65,99±6,79df |
10,53±0,44ab |
10,11±0,22ab |
4,95±1,35 |
|
aРазличия с аналогичным параметром при 18°С достоверны (p≤0,05) dРазличия с аналогичным параметром при 37°С достоверны (p≤0,05) fРазличия с аналогичным параметром при 40°С достоверны (p≤0,05) gРазличия с анал огичным параметром при 43°С достоверны (p≤0 ,05) |
||||
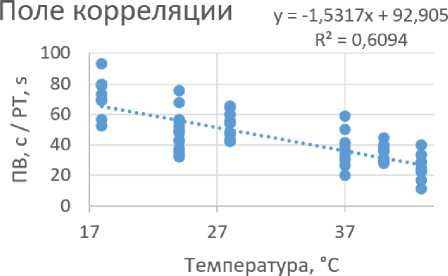
Корреляционно-регрессионный и однофакторный дисперсионный анализ (One-way ANOVA) выявили высокую зависимость от температуры ПВ и АЧТВ, коэффициент детерминации которых составил 60 и 44% соответственно (рис. 1).
Поле корреляции у = _8Л64х + 374,92 R2 = 0,4401
|
V) t |
500,00 400,00 |
|
1 1 CL < |
300,00 |
|
■^ |
200,00 |
|
со |
100,00 |
|
zr < |
0,00 |
Температура, °C
Рисунок 1 - Корреляционно-регрессионная зависимость ПВ и АЧТВ плазмы коров от температуры инкубации
В соответствии со шкалой Чеддока корреляционную связь между показателями гемостаза коров и температурным фактором можно охарактеризовать как отрицательную умеренную (АЧТВ; r=-0,44), заметную (ТВ, фибриноген; r=-0,51) и тесную (ПВ, АТ-III; r=-0,80)
У кур в результате изменения температуры инкубации плазмы были получены показатели активности свертывающего и противосвертывающего звена гемостаза представленные в таблице 2.
Таблица 2 - Сравнительный анализ показателей гемостаза кур при разных температурах
|
Показатель (n=19) |
18 |
Температура, °С 37 43 |
46 |
|
|
ТВ, с |
149,97±11,32cdf |
46,39±1,74a |
45,52±1,64a |
32,43±3,65a |
|
ПВ, с |
29,33±6,37cd |
83,13±15,36adf |
154,64±41,71aсf |
43,71±13,99cd |
|
АЧТВ, с |
84,72±15,23 |
64,56±7,67 |
78,82±12,41 |
86,86±17,56 |
|
Активность фибриногена, с |
25,35±4,99cdf |
93,88±9,75af |
109,15±11,27af |
395,60±32,99acd |
|
Антитромбин, с |
11,81±2,62cdf |
30,70±2,48a |
26,02±1,70a |
24,46±2,08a |
|
aРазличия с аналогичным параметром при 18°С достоверны (p≤0,05) cРазличия с аналогичным параметром при 37°С достоверны (p≤0,05) dРазличия с аналогичным параметром при 43°С достоверны (p≤0,05) f Различия с аналогичным параметром при 46°С достоверны (p≤0,05). |
||||
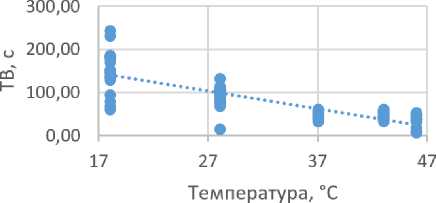
Корреляционно-регрессионный и однофакторный дисперсионный анализ (One-way ANOVA) у кур выявили высокую зависимость от тем- пературы ТВ и активности фибриногена, коэффициент детерминации которых составил 71 и 39% соответственно (рис. 2).
Поле корреляции v = -4,i238x + 2i5,i
R2 = 0,7057
Поле корреляции у = 8,87эзх-1бо,б4
R2 = 0,3934
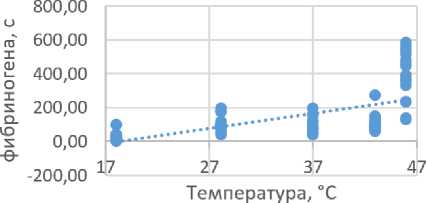
Рисунок 2 - Корреляционно-регрессионная зависимость ТВ и активности фибриногена плазмы кур от температуры инкубации
В соответствии со шкалой Чеддока корреляционную связь между показателями гемостаза кур и температурным фактором можно охарактеризовать как отрицательную высокую (ТВ; r=-0,8) и положительную высокую (фибриноген; r=0,8).
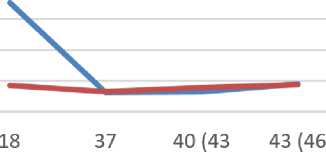
Сравнивая динамику показателей гемостаза кур и коров, можно отметить однотипность реакций тромбинового и активированного частичного тромбопластинового времени на изменение температуры инкубации плазмы и совершенно разные реакции протромбинового времени, активности фибриногена и антитромбина у этих животных (рис. 3, 4).
Динамика ТВ
Динамика АЧТВ
О
для кур) для кур)
Температура, °C
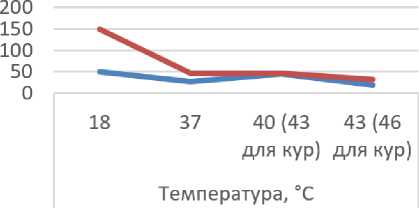
^—ТВ коров, с ^—ТВ кур, с
Рисунок 3 - Реакция ТВ и АЧТВ коров и кур на изменение температуры
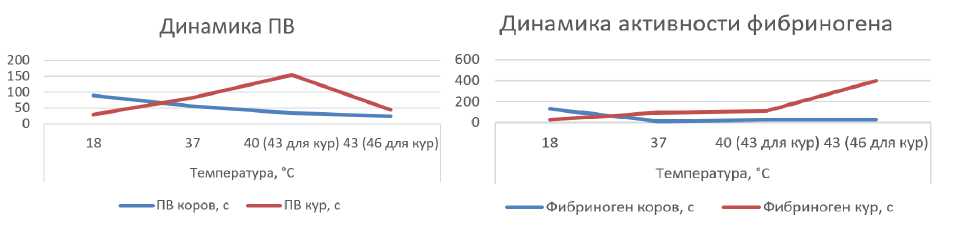
Динамика активности ^ антитромбина
18 37 40 (43 для кур) 43 (46 для кур)
Температура, °C
^^—Антитромбин коров, с ^^—Антитромбин кур, с
Рисунок 4 - Реакция ПВ, активности фибриногена и антитромбина коров и кур на изменение температуры
Обсуждение
Повышение температуры инкубации плазмы крови коров приводит к гиперкоагуляции крови in vitro, активируя каскад свертывания и угнетая активность противосвертывающей системы, гипотермия оказывает обратный эффект на эти два звена системы гемостаза. Полученные результаты согласуются с результатами зарубежных авторов, которые делают вывод, что гиперкоагуляции во время теплового удара вызывает локальную гипоперфузию, тканевую гипоксию и последующую органную дисфункцию [10], а гипотермия на модельных организмах может служить защитой от повышенного тромбообразования [11].
Анализируя полученные результаты можно заключить, что большая часть показателей, характеризующих плазменный гемостаз кур, ярко реагирует на изменение температуры инкубации, особенно на гипотермию, поэтому оптимизация диагностических процедур и определение референтных значений показателей свертываемости крови у птиц при температуре, свойственной этим позвоночным, могут улучшить диагностику нарушений гемостаза. Мы согласны с M. Buzala с соавторами, что процессы свертывания крови глубоко заложены в геноме современной домашней птицы, и поэтому признание механизмов гемостаза и улучшение диагностических процедур могут стать очень мощным инструментом генетического отбора [12].
Выводы
В результате проведенных исследований определено, что в плазме крови коров при гипертермии in vitro происходит укорочение тромбинового (ТВ) и протромбинового времени (ПВ), что свидетельствует о риске тромбообразования и может наблюдаться при первой фазе ДВС-синдрома (гиперкоагуляции) [13–16].
Выявлено, что активность антитромбина III при охлаждении плазмы коров до 18 oC выросла на 85% по сравнению с нормотермией (40oC), что согласуется с данными других исследователей, которые заключают, что легкая гипотермия оказывает антикоагулянтное действие при охлаждении и это может оказывать ингибирующее действие на образование микротромбов [11,17, 18, 19].
У кур ответ плазменного гемостаза сопровождался активацией свертывания крови и снижением активности антитромбина как при гипертермии (46°С), так и при гипотермии (18°С). Корреляционнорегрессионный и однофакторный дисперсионный анализ выявили высокую зависимость от температуры тромбинового времени птиц, коэффициент детерминации которого составил 71%.
Сравнивая реакцию показателей коагулограммы коров и кур на изменение температуры инкубации плазмы, можно отметить однотипность реакций тромбинового и активированного частичного тромбопластинового времени и совершенно разные реакции протромбинового времени, активности фибриногена и антитромбина у этих животных.
Исследование выполнено при финансовой поддержке Российского научного фонда № 23-26-00115,
Список литературы Влияние гипо- и гипертермии на коагуляционный гемостаз коров и кур in vitro
- Maden M., £ol R., Arican M., Ider M., Garip M., Tras B. The evaluation of hemostatic dysfunctionand disseminated intravascular coagula-tionin dairy cows with abomasal displacement. Polish Journal of Veterinary Sciences. 2018. Vol. 21, no. 4, pp. 769 -778. - Text: direct.
- Suvernev A.V., Ivanov G.V., Novozhilov S.Yu., Yefremov A.V. Intensive Hyperthermia Therapy. Siberian Research Institute of Hyperthermia. 2011. Р. 96. - Text: direct.
- Ostberg J.R. Regulation of immune activity by mild (fever-range) whole body hyperthermia: effects on epidermal Langerhans cells. Cell Stress Chaperones. 2000. Vol. 5, no. 5, pp. 458-461. - Text: direct.
- Tavares-Dias M., Oliveira S.R. A review of the blood coagulation system of fish. RevistaBrasileira de Biociencias. 2009. Vol. 7, no. 2, pp. 205-224. - Text: direct.
- Зависимость коагуляционной активности крови кур in vitro от температуры / Л.Л. Фомина, Д.И. Березина, Т.С. Кулакова, К.Э. Моданова. - Текст: непосредственный // Международный вестник ветеринарии. - 2023. - № 4. - С. 327-334.
- Зависимость коагуляционной активности крови коров in vitro от температуры / Л.Л. Фомина, Д.И. Березина, Т.С. Кулакова, К.Э. Моданова. // Аграраная наука Евро-Северо-Востока. - 2024. - Т. 25. № 1. - С. 90-97.
- Берковский. А.Л. Диагностика нарушений гемостаза у животных / А.Л. Берковский, Е.В. Сергеева, А.В. Суворов // Ветеринария. - 2018. - № 5. - С. 54-57.
- Баркаган, З.С. Диагностика и контролируемая терапия нарушений гемостаза / З.С. Баркаган, А.П. Момот. - М.: Ньюдиамед-АО, 2008. - 292 с. - URL:https://elibrary.ru/item.asp?id = 19050159
- Шихова, О.А. Математическая биостатистика: методические указания и индивидуальные задания / О.А. Шихова. - Вологда-Молочное: ФГБОУ ВО Вологодская ГМХА, 2017. - 44 с.
- Burhans W.S., Rossiter Burhans C.A., Baumgard L.H. Invited review: Lethal heat stress: The putative pathophysiology of a deadly disorder in dairy cattle. Journal of Dairy Science. 2022. Vol.105. I. 5. P. 3716-3735. DOI: 10.3168/jds.2021-21080. - Text: direct.
- Wu J., Yuan W., Li J. etal. Effects of Mild Hypothermia on Cerebral Large and Small Microvessels Blood Flow in a Porcine Model of Cardiac Arrest. Neurocrit Care. 2017. Vol.27. Р. 297-303. https://doi.org/10.1007/ s12028-017-0395-6. - Text: direct.
- Buzala M. et al. The mechanism of blood coagulation, its disorders and measurement in poultry. Livestock Science. 2017. Т.195, pp. 1-8. DOI http://dx.doi.org/10.1016/j.livsci.2016.11.009. - Text: direct.
- Min L, Cheng J, Zhao S, Tian H, Zhang Y, Li S, Yang H, Zheng N, Wang J. Plasma-based proteomics reveals immune response, complement and coagulation cascades pathway shifts in heat-stressed lactating dairy cows. Journal of Proteomics. 2016. Vol.146, pp. 99-108. DOI: 10.1016/j. jprot.2016.06.008
- Николаев В.Ю.,ШахматовИ.И., КиселевВ.И., Вдовин В.М. Система гемостаза крыс при разных режимах одиночной гипертермической нагрузки // Современные проблемы науки и образования. - 2014. № 4. - С. 509-509. URL: https://science-education.ru/en/article/view?id = 14114
- Bruchim Y., Kelmer E., Cohen A., Codner C., Segev G., Aroch I. Hemostatic abnormalities in dogs with naturally occurring heatstroke. J Vet Emerg Crit Care (San Antonio). 2017. V.27(3), pp.315-324. DOI: 10.1111/ vec.12590. - Text: direct.
- Proctor E A, Dineen SM, Van Nostrand SC, Kuhn MK, Barrett CD, Brubaker DK, Yaffe MB, Lauffenburger DA, Leon LR. Coagulopathy signature precedes and predicts severity of end-organ heat stroke pathology in a mouse model. Journal of thrombosis and haemostasis. 2020. V.18, no.8, pp. 1900-1910. DOI: 10.1111/jth.14875. - Text: direct.
- Xu S, Miao H, Gong L, Feng L, Hou X, Zhou M, Shen H, Chen W. Effects of Different Hypothermia on the Results of Cardiopulmonary Resuscitation in a Cardiac Arrest Rat Model. Dis Markers. 2022. Vol.1-2, pp. 1-11. DOI: 10.1155/2022/2005616. - Text: direct.
- Thienel M., Müller-Reif J. B., Zhang Z., Ehreiser V., Huth J., Shchu-rovska K., Kilani B еt al. Immobility-associated thromboprotection is conserved across mammalian species from bear to human. Science. 2023. 380(6641):178-187. DOI: https://doi.org/10.1126/science.abo5044. -Text: direct.
- Gong, P. Effect of mild hypothermia on the coagulation-fibrinolysis system and physiological anticoagulants after cardiopulmonary resuscitation in a porcine model / P. Gong, M.Y. Zhang, H. Zhao, Z.R. Tang, R. Hua, X. Mei, J. Cui, C.S. Li. PLoS One. 2013. Vol.20, no.8(6). DOI: https://doi. org/10.1371/journal.pone.0067476. - Text: direct.


