5,5-диэтил-2,2,2-трифенилбенз[с]оксафосфолан, синтез и строение
Автор: Рыбакова Анастасия Владимировна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 2 т.12, 2020 года.
Бесплатный доступ
Взаимодействием этилмагнийбромида с 5-оксо-2,2,2-трифенилбенз[ c ]-1,2-оксафосфоланом в эфире, последующим гидролизом реакционной смеси, удалением растворителя и перекристаллизацией целевого продукта из смеси бензол-октан (3:1 объемн.) с выходом 82 % получен 5,5-диэтил-2,2,2-трифенилбенз[ c ]-1,2-оксафосфолан (1). Методом рентгеноструктурного анализа (РСА) определено строение 1. РСА проводили на автоматическом четырехкружном дифрактометре D8 Quest Bruker (Мо Кα- излучение, λ = 0,71073 Å, графитовый монохроматор). Бесцветный кристалл С29Н29OP, размер 0,57×0,33×0,32 мм, P -1, a = 10,262(5), b = 12,194(6), c = 19,478(14) Å, a = 83,03(3), β = 81,67(3), g = 79,504(16) град., V = 2360(2) Å3, Z = 2, rвыч = 1,195 г/см3, µ = 0,135 мм-1, F (000) 904,0. Параметры ячейки и интенсивности 114431 отражений, из которых 13180 наблюдаемых с I ³ 3 s , измерены при 20 °С. Окончательные значения факторов расходимости: R 1 = 0,0426, wR 2 = 0,1003 (CCDC 1982346). В кристалле присутствуют два типа (A и B) кристаллографически независимых молекул 1. Координационный полиэдр атомов фосфора - тригональная бипирамида с атомом кислорода и фенильным лигандом в аксиальных положениях (аксиальные углы СРО равны 174,05(7)° и 170,82(8)°, причем одна из этильных групп в молекуле В разупорядочена по двум положениям, расстояния Р-О и Р-С составляют 1,7783(15), 1,7750(17) Å и 1,8296(19), 1,929(2) Å). Длины экваториальных связей изменяются в интервале 1,823(2)-1,867(2) Å, расстояния О-С равны 1,428(3), 1,419(4) Å. Суммы экваториальных углов СРС составляют 359,34° (132,17(9)°, 114,40(9)°, 112,77(9)°) и 359,47° (135,57(10)°, 112,44(9)°, 111,46(10)°), что близко к идеальному значению 360°. Атомы фосфора в молекулах А и В выходят из экваториальной плоскости к аксиальному фенильному заместителю на 0,086 и 0,077 Å соответственно.
Получение, 5, 5-диэтил-2, 2, 2-трифенилбенз[c]-1, 2-оксафосфолан, строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147234224
IDR: 147234224 | УДК: 546.185+547.53.024+548.312.5 | DOI: 10.14529/chem200202
Текст научной статьи 5,5-диэтил-2,2,2-трифенилбенз[с]оксафосфолан, синтез и строение
В литературе описаны синтез и строение различных оксафосфоланов [1 - 16], однако только в трех из них присутствует пятикоординированный фосфор, содержащий группировку PPh 3 [14 - 16]. Известно, что синтез производных бензоксафосфолов можно осуществить из арина, фосфина и активированных кетонов [14], однако существует более простой метод синтеза подобных соединений из пентафенилфосфора, который может легко отщеплять один из фенильных лигандов при действии различных реагентов, таких как спирты, кислоты [15, 17–20] и диоксид углерода [15]. Продуктом последней реакции является 5-оксо-2,2,2-трифенилбенз[ c ]-1,2-оксафосфолан, из которого с высоким выходом можно синтезировать широкий ряд замещенных бензоксафосфолов [16, 21, 22].
Экспериментальная часть
Синтез 5,5-диэтил-2,2,2-трифенилбенз[c]-1,2-оксафосфолана (1) проводили по методике, описанной в [23]. Выход 82 %, т. пл. 120 °С. ИК-спектр, v , см - 1: 3064, 3053, 3022, 2970, 2960, 2929, 2875, 1950, 1894, 1822, 1764, 1587, 1481, 1463, 1433, 1375, 1327, 1309, 1290, 1263, 1222, 1186, 1165, 1145, 1122, 1111, 1082, 1076, 1060, 1041, 1033, 1018, 974, 920, 875, 840, 798, 767, 754, 731, 713, 702, 694, 671, 665, 646, 619, 596, 576, 559, 549, 532, 522, 503, 482, 462, 428.
ИК-спектр соединения 1 записывали на ИК-Фурье спектрометре Shimadzu IRAffinity-1S втаблетке KBr в области 4000 - 400 см - 1.
Рентгеноструктурный анализ кристаллов соединения 1 проводили на дифрактометре D8 Quest фирмы Broker (Mo K„-излучение, X 0,71073 A, графитовый монохроматор) при 293 К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [23]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [24] и OLEX2 [25]. Структура определена прямым методом и уточнена методом наименьших квадратов в анизотропном приближении для неводородных атомов. Основные кристаллографические данные и результаты уточнения структуры 1 приведены в табл. 1, основные длины связей и валентные углы - в табл. 2.
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1982346; ; [26].
Кристаллографические данные, параметры эксперимента и уточнения структуры 1
Длины связей и валентные углы для структуры 1
Таблица 1
|
Параметр |
Значение |
|
Формула |
C 58 H 58 O 2 P 2 |
|
М |
848,98 |
|
Сингония |
Триклинная |
|
Пр. группа |
P– 1 |
|
a , Å |
10,262(5) |
|
b , Å |
12,194(6) |
|
c , Å |
19,478(14) |
|
α, град. |
83,03(3) |
|
β, град. |
81,67(3) |
|
γ, град. |
79,504(16) |
|
V , Å3 |
2360(2) |
|
Z |
2 |
|
р (выч.), г/см 3 |
1,195 |
|
ц , мм-1 |
0,135 |
|
F (000) |
904,0 |
|
Форма кристалла (размер, мм) |
0,57 × 0,33 × 0,32 |
|
Область сбора данных по 2 9 , град. |
5,7 - 59,26 |
|
Интервалы индексов отражений |
–14 ≤ h ≤ 14, –16 ≤ k ≤ 16, –26 ≤ l ≤ 26 |
|
Измерено отражений |
114431 |
|
Независимых отражений |
13180 |
|
R int |
0,0393 |
|
Переменных уточнения |
563 |
|
GOOF |
1,012 |
|
R -факторы по F 2 > 2 о ( F 2) |
R 1 = 0,0426, wR 2 = 0,1003 |
|
R -факторы по всем отражениям |
R 1 = 0,0799, wR 2 = 0,1893 |
|
Остаточная электронная плотность (min/max), e/A3 |
1,73/–0,66 |
Таблица 2
|
Связь d , Å |
Угол го, град. ° |
||
|
P(1) - O(1) |
1,7783(15) |
O(1)P(1)C31 |
85,48(8) |
|
P(1) - C(31) |
1,858(2) |
O(1)P(1)C(21) |
174,05(7) |
|
P(1) - C(1) |
1,864(2) |
C(31)P(1)C(1) |
132,17(9) |
|
P(1) - C(11) |
1,8296(19) |
C(11)P(1)C(31) |
114,40(9) |
|
P(1) - C(21) |
1,926(2) |
C(11)P(1)C(1) |
112,77(9) |
|
P(2) - O(2) |
1,7750(17) |
C(11)P(1)C(21) |
95,35(8) |
|
P(2) - C(41) |
1,867(2) |
O(2)P(2)C(41) |
85,43(9) |
|
P(2) - C(51) |
1,929(2) |
O(2)P(2)C(51) |
170,82(8) |
|
P(2) - C(71) |
1,848(2) |
C(71)P(2)C(41) |
135,57(10) |
|
P(2) - C(61) |
1,823(2) |
C(61)P(2)C(41) |
112,44(9) |
|
O(1) - C(37) |
1,428(3) |
C(61)P(2)C(51) |
96,32(9) |
|
O(2) - C(77) |
1,419(3) |
C(61)P(2)C(71) |
111,46(10) |
Обсуждение результатов
К настоящему времени известны два способа синтеза производных бензоксафосфолана, по первому из которых их получение осуществляют из арина, фосфина и активированных кетонов [14], а во втором в качестве прекурсора бензоксафосфолана используют 5-оксо-2,2,2-трифенилбенз[ c ]-1,2-оксафосфолан [16, 21, 22].
В продолжение исследования синтеза и особенностей строения фенильных производных пятивалентного фосфора [19] исследованы особенности взаимодействия 5-оксо-2,2,2-трифенилбенз[ c ]-1,2-оксафосфолана с этилмагнийбромидом:
+ EtMgBr
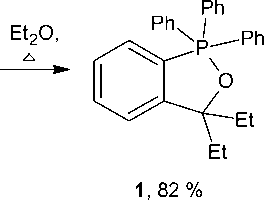
Противоречивые данные о температуре плавления полученного 5,5-диэтил-2,2,2-трифенил-бенз[ c ]-1,2-оксафосфолана (118 ° С [22] и 124 ° С [16]) заставили тщательно повторить эксперимент, в результате которого были уточнены температура плавления целевого продукта (120 ° С) и выход соединения 1 , полученного по методике [22]. Ранее была определена методом РСА его структура [16], в настоящей работе уточнено строение 1 . В кристалле присутствуют два типа (A и B) кристаллографически независимых молекул 1 . Координационный полиэдр атомов фосфора – тригональная бипирамида (см. рисунок) с атомом кислорода и фенильным лигандом в аксиальных положениях (аксиальные углы СРО равны 174,05(7) ° (А) и 170,82(8) ° (В), причем одна из этильных групп в молекуле В разупорядочена по двум положениям, расстояния Р - О и Р - С в молекулах А и В составляют 1,7783(15), 1,7750(17) Å и 1,8296(19), 1,929(2) Å) соответственно, что незначительно отличается от суммы ковалентных радиусов соответствующих атомов [27].
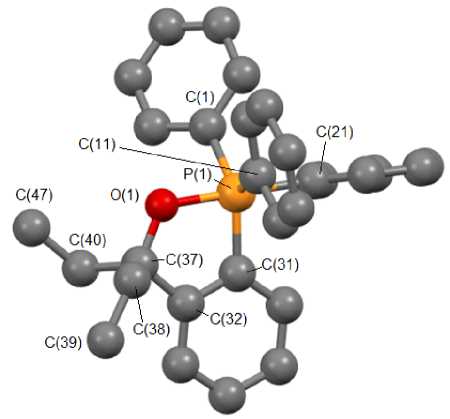
Строение молекулы А 5,5-диэтил-2,2,2-трифенилбенз[ c ]-1,2-оксафосфолана (1) (атомы водорода не показаны)
Длины экваториальных связей изменяются в интервале 1,823(2) - 1,867(2) А, расстояния О - С равны 1,428(3) Å (в молекуле А), 1,419(4) Å (в молекуле В). Суммы экваториальных углов СРС в молекулах А и В составляют 359,34 ° (132,17(9) ° , 114,40(9) ° , 112,77(9) ° ) и 359,47 ° (135,57(10) ° , 112,44(9) ° , 111,46(10) ° ), что близко к идеальному значению 360 ° . Атомы фосфора выходят из экваториальной плоскости к аксиальному фенильному заместителю на 0,086 и 0,077 Å соответственно.
В ИК-спектре 1 колебания групп P-Ph наблюдаются в виде уширенной интенсивной полосы с частотой поглощения 1433 см–1. К деформационным колебаниям связей (P-Ph) могут быть отнесены полосы средней интенсивности при 1082 и 1033 см–1. Кроме того, в ИК-спектре соединения 1 имеются полосы поглощения ( ν , cм - 1): 974, 1041–1060 (Р-О-С). Следует отметить, что отсутствует полоса колебания С=О группы, характерная для ИК-спектра исходного 5-оксо-2,2,2-трифенилбенз[ c ]-1,2-оксафосфолана.
Выводы
В настоящей работе уточнены выход, температура плавления и особенности строения 5,5-диэтил-2,2,2-трифенилбенз[ c ]-1,2-оксафосфолана.
Выражаю признательность проф. В.В. Шарутину за рентгеноструктурный анализ кристалла соединения 1 .
Список литературы 5,5-диэтил-2,2,2-трифенилбенз[с]оксафосфолан, синтез и строение
- Toullec, P. Hetero-Diels-Alder Reactions of 2#-Phospholes with Aldehydes / P. Toullec, L. Ricard, F. Mathey // J. Org. Chem. - 2003. - V. 68, № 7. - P. 2803-2806. DOI: 10.1021/jo020720j.
- Synthesis and Chemistry of 2-Phosphafurans / M.P. Duffy, Y. Lin, F. Ho et al. // Organometal-lics. - 2010. - V. 29, № 22. - P. 5757-5758. DOI: 10.1021/om100778f.
- Kyri, A.W. A Novel Route to C-unsubstituted 1,2-Oxaphosphetane and 1,2-Oxaphospholane Complexes / A.W. Kyri, G. Schnakenburg, R. Streubel // Chem. Commun. - 2016. - V. 52, № 55. -P. 8593-8595. DOI: 10.1039/C6CC04667C.
- Evidence for Terminal Phosphinidene Oxide Complexes in O,P,C-Cage Complex Formation: Rearrangement of Oxaphosphirane Complexes / R. Streubel, C. Murcia-Garcia, G. Schnakenburg et al. // Organometallics. - 2015. - V. 34, iss. 11. - P. 2676-2682. DOI: 10.1021/acs.organomet.5b00029.
- Миронов, В.Ф. Каркасные соединения тетракоординированного фосфора с эндоцикличе-скими связями Р-С: синтез и реакционная способность / В.Ф. Миронов, Г.А. Ивкова, Л.М. Бурнаева // Журн. общ. химии. - 2016. - Т. 86, № 12. - С. 1987-1999.
- Formation of a Bowl-Shaped, Pentacyclic Phosphonium Cage by Methylation of a Nucleophilic Phosphinidene / M. Driess, N. Muresan, K. Merz et al. // Angew. Chem., Int. Ed. - 2005. - V. 44, iss. 41. - P. 6734-6737. DOI: 10.1002/anie.200501990.
- Double Diastereoselective Intramolecular Cyclopropanation to W-Chiral [3.1.0]-Bicyclic Phos-phonates / J.D. Moore, K.T. Sprott, A.D. Wrobleski et al. // Org. Lett. - 2002. - V. 4, iss. 4. - P. 23572360. DOI: 10.1021/ol026080o.
- Moore, J.D. Conformationally Constrained a-Boc-Aminophosphonates via Transition Metal-Catalyzed/Curtius Rearrangement Strategies / J.D. Moore, K.T. Sprott, P.R. Hanson // J. Org. Chem. -2002. - V. 67, iss. 23. - P. 8123-8129. DOI: 10.1021/jo0262208.
- Double Diastereoselective Intramolecular Cyclopropanation to W-Chiral [3.1.0]-Bicyclic Phos-phonates / J.D. Moore, K.T. Sprott, A.D. Wrobleski et al. // Org. Lett. - 2002. - V. 4, iss. 14. - P. 23572360. DOI: 10.1021/ol026080o.
- Moore, J.D. Substituent Effects in the Double Diastereotopic Differentiation of a-Diazo-phosphonates Via Intramolecular Cyclopropanation / J.D. Moore, P.R. Hanson // Tetrahedron: Asymm. - 2003. - V. 14, iss. 7. - P. 873-880. DOI: 10.1016/S0957-4166(03)00081-8.
- CPh3 as a Functional Group in P-heterocyclic Chemistry: Elimination of HCPh3 in the Reaction of/'-CPh;, Substituted Li/Cl Phosphinidenoid Complexes with Ph2C=0 / C.M. Garcia, A.E. Ferao, G. Schnakenburg et al. // Dalton Trans. - 2016. - V. 45, iss. 6 - P. 2378-2385. DOI: 10.1039/C5DT04595A.
- Hatano, M. Cover Picture: Chiral Magnesium(II) Binaphtholates as Cooperative Bransted/Lewis Acid-Base Catalysts for the Highly Enantioselective Addition of Phosphorus Nucleophiles to a,p-Unsaturated Esters and Ketones / M. Hatano, T. Horibe, K. Ishihara // Angew. Chem., Int. Ed. -2013. - V. 52, Iss. 17. - P. 4549-4554. DOI: 10.1002/anie.201302124.
- Bestmann, H.J. Phosphinalkylene, 50. Zur Struktur von 2,2,2-Triphenyl-1,2^5-oxaphospholanen / H.J. Bestmann, C. Riemer, R. Dotzer // Chem.Ber. - 1992. - V. 125, iss. 1. - P. 225229. DOI: 10.1002/cber.19921250135.
- Rapid Access to Benzoxaphospholes and Their Spiro Analogues by a Three-Component Coupling Involving Arynes, Phosphines, and Activated Ketones / A. Bhunia, T. Roy, R.G. Gonnade et al. // Org. Lett. - 2014. - V. 16, iss. 19. - P. 5132-5135. DOI: 10.1021/ol502490t.
- Термолиз пентафенилфосфорана в присутствии диоксида углерода / В.В. Шарутин, В.Т. Бычков, В.А. Лебедев и др. // ЖОХ. - 1986. - Т. 56, вып. 2. - С. 325-328.
- Взаимодействие пентафенилфосфорана с параформом / В.В. Жидков, В.В. Шарутин, В.К. Бельский и др. // ЖОХ. - 1995. - Т. 65, вып. 2. - С. 251 - 256.
- Alkyloxy- and Silyloxy-derivatives of PV and SbV / G.A. Razuvaev, N.A. Osanova, T.G. Brilkina et al. // J. Organometal. Chem. - 1975. - V. 99, Iss. 1. - P. 93-106. DOI: 10.1016/S0022-328X(00)86365-2.
- Синтез и строение карбоксилатов и сульфонатов тетрафенилфосфония / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // ЖОХ. - 2009. - Т. 79, вып. 1. - С. 80 - 89.
- Синтез и строение карбоксилатов тетрафенилфосфония / В.В. Шарутин, О.К. Шарутина, A.В. Рыбакова и др. // ЖОХ. - 2018. - Т. 88, вып. 8. - С. 1308-1313. DOI: 10.1134/S0044460X18080139.
- Шарутин, В.В. Синтез и строение 2,4-динитробензолсульфоната тетрафенилфосфония. B.В. Шарутин, Н. Мукушева, А.В. Уржумова // Вестник ЮУрГУ. Серия «Химия». - 2018. - Т. 10, № 2. - С. 48-54. DOI: 10.14529/chem180206.
- Шарутин, В.В. Роль стерических факторов в процессах термического разложения пента-фенильных соединений фосфора, сурьмы, висмута / В.В. Шарутин // ЖОХ. - 1988. - Т. 58, вып. 10. - С. 2305-2311.
- Шарутин, В.В. Реакции 5-оксо-2,2,2-трифенилбенз[с]-1,2-оксафосфолана с реактивом гриньяра и иодистоводородной кислотой. Термолиз иодида трифенил-(о-карбоксифенил)-фосфония / В.В. Шарутин // ЖОХ. - 1990. - Т. 60, вып. 6. - С. 1265-1267.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures From Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: a Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. - 2009. - V. 42. - P. 339-341. DOI: 10.1107/S0021889808042726.
- The Cambridge Crystallographic Database. Release. 2019. Cambridge. http://www.ccdc.cam.ac.uk.
- Бацанов, С.С. Атомные радиусы элементов / С.С. Бацанов // Журн. неорган. химии. -1991. - Т. 36, № 12. - С. 3015-3037.

![5,5-диэтил-2,2,2-трифенилбенз[с]оксафосфолан, синтез и строение 5,5-диэтил-2,2,2-трифенилбенз[с]оксафосфолан, синтез и строение](/file/cover/147234224/55-dijetil-222-trifenilbenz-s-oksafosfolan-sintez-i-stroenie.png)
